Der Stirling-Zyklus
Storyboard 
Eine thermodynamische Maschine, die nicht auf interne Verbrennung angewiesen ist, sondern ausschließlich äußere Wärmezufuhr erhält. Durch diesen Prozess entsteht dennoch der typische Druck-Volumen-Zyklus, was es ermöglicht, die erzielte Effizienz zu modellieren und zu berechnen.
ID:(1485, 0)
Mechanismen
Definition 
Der Stirling-Zyklus umfasst vier Hauptphasen: Heizen, Expandieren, Kühlen und Komprimieren, die in einer abgedichteten Umgebung durchgeführt werden, in der ein Gas wie Helium oder Wasserstoff als Arbeitsmedium dient.
Während der Heizphase wird das Gas bei konstantem Volumen erhitzt, wobei es Wärme aus einer externen Quelle aufnimmt, was seine Temperatur und seinen Druck erhöht. Dies wird gefolgt von der Expansionsphase, in der das erhitzte Gas expandiert und Arbeit an einem Kolben oder einem anderen Mechanismus verrichtet, wobei seine Temperatur und sein Druck sinken, aber die Wärme in mechanische Energie umgewandelt wird.
Dann erfolgt die Kühlphase bei konstantem Volumen. Hier verliert das Gas Wärme, was seine Temperatur und seinen Druck verringert und es auf die letzte Phase vorbereitet. Der Regenerator spielt eine entscheidende Rolle, indem er Wärme aus dem Gas aufnimmt, was Energie spart und die Effizienz erhöht.
Der Zyklus endet mit der Kompression des abgekühlten Gases, die weniger Energie erfordert als die während der Expansion erzeugte. Diese Kompression erhöht die Temperatur des Gases, wenn auch nicht so stark wie in der anfänglichen Heizphase, und der Zyklus beginnt von neuem.
Der Regenerator ist während dieses gesamten Prozesses von entscheidender Bedeutung, da er Wärme aus der Kühlphase speichert und während der Heizphase zurückführt, wodurch Energie innerhalb des Systems wiederverwendet und die thermische Effizienz des Motors erheblich gesteigert wird. Stirlingmotoren sind wegen ihres leisen Betriebs und der Flexibilität, jede Wärmequelle zu nutzen, geschätzt, was sie anpassungsfähig und umweltfreundlich für verschiedene Anwendungen macht.
ID:(15284, 0)
Carnot-Zyklus
Bild 
Sadi Carnot führte [1] das theoretische Konzept der ersten Maschinenkonstruktion ein, die auf einem Temperaturgradienten basierend mechanische Arbeit erzeugen kann. Dies wird durch einen Prozess im Druck-Volumen-Raum erreicht, bei dem Wärme hinzugefügt und extrahiert wird, wie in der Abbildung dargestellt:
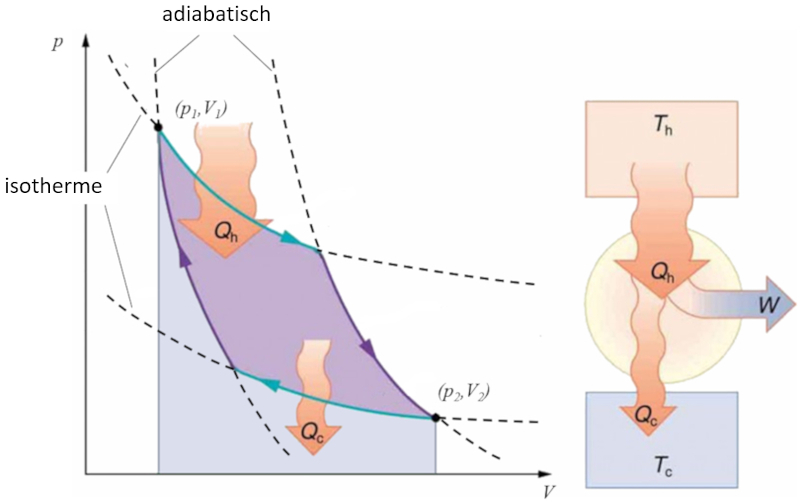
Die Fläche unter der Kurve der Wärme zugeführt ($Q_H$), die von 1 bis 2 reicht, repräsentiert die erforderliche Energiezufuhr, um vom Zustand ($p_1, V_1$) zum Zustand ($p_2, V_2$) überzugehen. Umgekehrt repräsentiert die Fläche unter der Kurve der Absorbierte Wärme ($Q_C$), die von 2 bis 1 verläuft, die benötigte Energieentnahme, um vom Zustand ($p_2, V_2$) zurück zum Zustand ($p_1, V_1$) zu gelangen. Die Differenz zwischen diesen Flächen entspricht dem von beiden Kurven umschlossenen Bereich und repräsentiert der Effektive Arbeit ($W$), den das System ausführen kann.
Carnot zeigte auch, dass gemäß dem zweiten Hauptsatz der Thermodynamik der Wärme zugeführt ($Q_H$) nicht null sein kann. Dies impliziert, dass es keine Maschinen gibt, die in der Lage sind, die gesamte Wärme in Arbeit umzuwandeln.
![]() [1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexionen über die Triebkraft des Feuers und über Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, S. 393-457 (1872)
[1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexionen über die Triebkraft des Feuers und über Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, S. 393-457 (1872)
ID:(11131, 0)
Stirling-Zyklus: Druck-Volumen-Diagramm
Notiz 
Der Stirling-Zyklus [1] kann als technische Lösung betrachtet werden, die auf dem Carnot-Zyklus basiert, der aus vier genau definierten Phasen besteht:
Phase 1 bis 2: Isotherme Kompression $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_1)$.
Phase 2 bis 3: Isokorische Erwärmung $(p_2,V_2,T_1)\rightarrow(p_3,V_2,T_2)$.
Phase 3 bis 4: Isotherme Expansion $(p_3,V_2,T_2)\rightarrow(p_4,V_1,T_2)$.
Phase 4 bis 1: Isokorisches Abkühlen $(p_4,V_1,T_2)\rightarrow(p_1,V_1,T_1)$.
Es ist wichtig zu betonen, dass dieser Zyklus keine adiabatische Phase beinhaltet; stattdessen basiert er auf dem Austausch zwischen isochoren Prozessen (bei konstantem Volumen) und isothermen Prozessen (bei konstanter Temperatur).
Diese Phasen können im folgenden Diagramm visualisiert werden:

![]() [1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Ein wirtschaftlicher Motor zum Zwecke der Wasserförderung durch die expansive Kraft von Dampf), Robert Stirling, Britisches Patent Nr. 4081 von 1816.
[1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Ein wirtschaftlicher Motor zum Zwecke der Wasserförderung durch die expansive Kraft von Dampf), Robert Stirling, Britisches Patent Nr. 4081 von 1816.
ID:(15362, 0)
Stirling-Zyklus 1 bis 2
Zitat 
In der ersten Stufe der Anzahl der Mol ($n$) wird das Gas mit der Am System durchgeführte Arbeiten ($W_{in}$) von der Erweitertes Volumen ($V_1$) auf der Komprimiertes Volumen ($V_2$) isotherm auf die Temperatur im Zustand 1 ($T_1$) mit der Anzahl der Mol ($n$) und die Druck ($p$) berechnet, das von der Erweitertes Volumen ($V_1$) bis der Komprimiertes Volumen ($V_2$) in der Volumen ($V$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe von die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) mithilfe der Gasgleichung
| $ p V = n R_C T $ |
erhalten wird, ergibt sich das Integral für die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
ID:(15760, 0)
Stirling-Zyklus 2 bis 3
Übung 
In der zweiten Stufe wird der Wärme zugeführt ($Q_H$) hinzugefügt, was abhängig von die Wärmekapazität bei konstantem Volumen ($C_V$) die Temperatur von die Temperatur im Zustand 1 ($T_1$) auf die Temperatur im Zustand 2 ($T_2$) erhöht:

Durch die Zufuhr von der Wärme zugeführt ($Q_H$) steigt die Temperatur des Gases von $T_2$ auf $T_3$ in einem isochoren Prozess (bei konstantem Volumen). Dies bedeutet, dass wir die Beziehung für ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden können, die durch die folgende Gleichung ausgedrückt wird:
| $ dU = C_V \Delta T $ |
Dies führt zu den Werten von die Temperatur im Zustand 2 ($T_2$) und die Temperatur im Zustand 3 ($T_3$) wie folgt:
| $ Q_h = C_V ( T_2 - T_1 )$ |
ID:(15761, 0)
Stirling-Zyklus 3 bis 4
Gleichung 
In der dritten Stufe der Anzahl der Mol ($n$) dehnt sich das Gas auf der Vom System ausgeführte Arbeit ($W_{out}$) aus, während sich das Volumen isotherm von der Komprimiertes Volumen ($V_2$) auf der Erweitertes Volumen ($V_1$) ausdehnt var>8490:

Die Arbeit wird durch die Integration von der Vom System ausgeführte Arbeit ($W_{out}$) mit die Druck ($p$) berechnet, die von ERROR:8458 bis der Erweitertes Volumen ($V_1$) in der Komprimiertes Volumen ($V_2$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe der Gleichung für Gase, nämlich
| $ p V = n R_C T $ |
durch die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) erhalten wird, ergibt sich das Integral für die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
ID:(15762, 0)
Stirling-Zyklus 4 bis 1
Script 
In der vierten Stufe wird der Absorbierte Wärme ($Q_C$) reduziert, wodurch, abhängig von die Wärmekapazität bei konstantem Volumen ($C_V$), die Temperatur von die Temperatur im Zustand 2 ($T_2$) auf die Temperatur im Zustand 1 ($T_1$) sinkt :
|
|
Beim Entfernen von der Absorbierte Wärme ($Q_C$), wenn der Volumen ($V$) gleich ERROR:8498,0 ist, erhöht sich die Absolute Temperatur ($T$) von die Temperatur im Zustand 1 ($T_1$) auf die Temperatur im Zustand 2 ($T_2$). Dies impliziert, dass wir die Beziehung für ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden können, die durch die Gleichung ausgedrückt wird:
| $ dU = C_V \Delta T $ |
dies führt uns zu dem Ausdruck:
| $ Q_c = C_V ( T_1 - T_2 )$ |
ID:(15763, 0)
Leistung des Stirling-Zyklus
Variable 
Die Leistungsfähigkeit ($\eta$) wird als das Verhältnis von der Effektive Arbeit ($W$) zu der Wärme trug zum System bei ($Q$) definiert:
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
wobei der Effektive Arbeit ($W$) in Beziehung zu der Vom System ausgeführte Arbeit ($W_{out}$) und der Am System durchgeführte Arbeiten ($W_{in}$) steht durch:
| $ W \equiv W_{out} - W_{in} $ |
während der Wärme trug zum System bei ($Q$) mit der Wärme zugeführt ($Q_H$) verbunden ist, was wie folgt definiert wird:
| $ Q \equiv W_{in} + Q_h $ |
Da der Vom System ausgeführte Arbeit ($W_{out}$) in Beziehung zu der Anzahl der Mol ($n$), die Temperatur im Zustand 2 ($T_2$), der Erweitertes Volumen ($V_1$), der Komprimiertes Volumen ($V_2$) und die Universelle Gas Konstante ($R_C$) steht durch:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Am System durchgeführte Arbeiten ($W_{in}$) mit die Temperatur im Zustand 1 ($T_1$) verbunden ist durch:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Wärme zugeführt ($Q_H$) mit die Wärmekapazität bei konstantem Volumen ($C_V$) verbunden ist durch:
| $ Q_h = C_V ( T_2 - T_1 )$ |
kann die Leistungsfähigkeit ($\eta$) berechnet werden, was zu folgendem Ergebnis führt:
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
ID:(15764, 0)
Der Stirling-Zyklus
Beschreibung 
Eine thermodynamische Maschine, die nicht auf interne Verbrennung angewiesen ist, sondern ausschließlich äußere Wärmezufuhr erhält. Durch diesen Prozess entsteht dennoch der typische Druck-Volumen-Zyklus, was es ermöglicht, die erzielte Effizienz zu modellieren und zu berechnen.
Variablen
Berechnungen
Berechnungen
Gleichungen
Durch die Zufuhr von der Wärme zugeführt ($Q_H$) steigt die Temperatur des Gases von $T_2$ auf $T_3$ in einem isochoren Prozess (bei konstantem Volumen). Dies bedeutet, dass wir die Beziehung f r ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden k nnen, die durch die folgende Gleichung ausgedr ckt wird:
| $ dU = C_V \Delta T $ |
Dies f hrt zu den Werten von die Temperatur im Zustand 2 ($T_2$) und die Temperatur im Zustand 3 ($T_3$) wie folgt:
| $ Q_h = C_V ( T_2 - T_1 )$ |
(ID 15363)
Beim Entfernen von der Absorbierte Wärme ($Q_C$), wenn der Volumen ($V$) gleich ERROR:8498,0 ist, erh ht sich die Absolute Temperatur ($T$) von die Temperatur im Zustand 1 ($T_1$) auf die Temperatur im Zustand 2 ($T_2$). Dies impliziert, dass wir die Beziehung f r ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden k nnen, die durch die Gleichung ausgedr ckt wird:
| $ dU = C_V \Delta T $ |
dies f hrt uns zu dem Ausdruck:
| $ Q_c = C_V ( T_1 - T_2 )$ |
(ID 15364)
Die Arbeit wird mithilfe des Integrals von der Am System durchgeführte Arbeiten ($W_{in}$) mit der Anzahl der Mol ($n$) und die Druck ($p$) berechnet, das von der Erweitertes Volumen ($V_1$) bis der Komprimiertes Volumen ($V_2$) in der Volumen ($V$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe von die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) mithilfe der Gasgleichung
| $ p V = n R_C T $ |
erhalten wird, ergibt sich das Integral f r die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15365)
Die Arbeit wird durch die Integration von der Vom System ausgeführte Arbeit ($W_{out}$) mit die Druck ($p$) berechnet, die von ERROR:8458 bis der Erweitertes Volumen ($V_1$) in der Komprimiertes Volumen ($V_2$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe der Gleichung f r Gase, n mlich
| $ p V = n R_C T $ |
durch die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) erhalten wird, ergibt sich das Integral f r die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15366)
(ID 15757)
Die Leistungsfähigkeit ($\eta$) wird als das Verh ltnis von der Effektive Arbeit ($W$) zu der Wärme trug zum System bei ($Q$) definiert:
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
wobei der Effektive Arbeit ($W$) in Beziehung zu der Vom System ausgeführte Arbeit ($W_{out}$) und der Am System durchgeführte Arbeiten ($W_{in}$) steht durch:
| $ W \equiv W_{out} - W_{in} $ |
w hrend der Wärme trug zum System bei ($Q$) mit der Wärme zugeführt ($Q_H$) verbunden ist, was wie folgt definiert wird:
| $ Q \equiv W_{in} + Q_h $ |
Da der Vom System ausgeführte Arbeit ($W_{out}$) in Beziehung zu der Anzahl der Mol ($n$), die Temperatur im Zustand 2 ($T_2$), der Erweitertes Volumen ($V_1$), der Komprimiertes Volumen ($V_2$) und die Universelle Gas Konstante ($R_C$) steht durch:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Am System durchgeführte Arbeiten ($W_{in}$) mit die Temperatur im Zustand 1 ($T_1$) verbunden ist durch:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Wärme zugeführt ($Q_H$) mit die Wärmekapazität bei konstantem Volumen ($C_V$) verbunden ist durch:
| $ Q_h = C_V ( T_2 - T_1 )$ |
kann die Leistungsfähigkeit ($\eta$) berechnet werden, was zu folgendem Ergebnis f hrt:
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
(ID 15759)
Beispiele
Der Stirling-Zyklus umfasst vier Hauptphasen: Heizen, Expandieren, K hlen und Komprimieren, die in einer abgedichteten Umgebung durchgef hrt werden, in der ein Gas wie Helium oder Wasserstoff als Arbeitsmedium dient.
W hrend der Heizphase wird das Gas bei konstantem Volumen erhitzt, wobei es W rme aus einer externen Quelle aufnimmt, was seine Temperatur und seinen Druck erh ht. Dies wird gefolgt von der Expansionsphase, in der das erhitzte Gas expandiert und Arbeit an einem Kolben oder einem anderen Mechanismus verrichtet, wobei seine Temperatur und sein Druck sinken, aber die W rme in mechanische Energie umgewandelt wird.
Dann erfolgt die K hlphase bei konstantem Volumen. Hier verliert das Gas W rme, was seine Temperatur und seinen Druck verringert und es auf die letzte Phase vorbereitet. Der Regenerator spielt eine entscheidende Rolle, indem er W rme aus dem Gas aufnimmt, was Energie spart und die Effizienz erh ht.
Der Zyklus endet mit der Kompression des abgek hlten Gases, die weniger Energie erfordert als die w hrend der Expansion erzeugte. Diese Kompression erh ht die Temperatur des Gases, wenn auch nicht so stark wie in der anf nglichen Heizphase, und der Zyklus beginnt von neuem.
Der Regenerator ist w hrend dieses gesamten Prozesses von entscheidender Bedeutung, da er W rme aus der K hlphase speichert und w hrend der Heizphase zur ckf hrt, wodurch Energie innerhalb des Systems wiederverwendet und die thermische Effizienz des Motors erheblich gesteigert wird. Stirlingmotoren sind wegen ihres leisen Betriebs und der Flexibilit t, jede W rmequelle zu nutzen, gesch tzt, was sie anpassungsf hig und umweltfreundlich f r verschiedene Anwendungen macht.
(ID 15284)
Sadi Carnot f hrte [1] das theoretische Konzept der ersten Maschinenkonstruktion ein, die auf einem Temperaturgradienten basierend mechanische Arbeit erzeugen kann. Dies wird durch einen Prozess im Druck-Volumen-Raum erreicht, bei dem W rme hinzugef gt und extrahiert wird, wie in der Abbildung dargestellt:

Die Fl che unter der Kurve der Wärme zugeführt ($Q_H$), die von 1 bis 2 reicht, repr sentiert die erforderliche Energiezufuhr, um vom Zustand ($p_1, V_1$) zum Zustand ($p_2, V_2$) berzugehen. Umgekehrt repr sentiert die Fl che unter der Kurve der Absorbierte Wärme ($Q_C$), die von 2 bis 1 verl uft, die ben tigte Energieentnahme, um vom Zustand ($p_2, V_2$) zur ck zum Zustand ($p_1, V_1$) zu gelangen. Die Differenz zwischen diesen Fl chen entspricht dem von beiden Kurven umschlossenen Bereich und repr sentiert der Effektive Arbeit ($W$), den das System ausf hren kann.
Carnot zeigte auch, dass gem dem zweiten Hauptsatz der Thermodynamik der Wärme zugeführt ($Q_H$) nicht null sein kann. Dies impliziert, dass es keine Maschinen gibt, die in der Lage sind, die gesamte W rme in Arbeit umzuwandeln.
![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexionen ber die Triebkraft des Feuers und ber Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, S. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexionen ber die Triebkraft des Feuers und ber Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, S. 393-457 (1872)
(ID 11131)
Der Stirling-Zyklus [1] kann als technische L sung betrachtet werden, die auf dem Carnot-Zyklus basiert, der aus vier genau definierten Phasen besteht:
Phase 1 bis 2: Isotherme Kompression $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_1)$.
Phase 2 bis 3: Isokorische Erw rmung $(p_2,V_2,T_1)\rightarrow(p_3,V_2,T_2)$.
Phase 3 bis 4: Isotherme Expansion $(p_3,V_2,T_2)\rightarrow(p_4,V_1,T_2)$.
Phase 4 bis 1: Isokorisches Abk hlen $(p_4,V_1,T_2)\rightarrow(p_1,V_1,T_1)$.
Es ist wichtig zu betonen, dass dieser Zyklus keine adiabatische Phase beinhaltet; stattdessen basiert er auf dem Austausch zwischen isochoren Prozessen (bei konstantem Volumen) und isothermen Prozessen (bei konstanter Temperatur).
Diese Phasen k nnen im folgenden Diagramm visualisiert werden:

![]() [1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Ein wirtschaftlicher Motor zum Zwecke der Wasserf rderung durch die expansive Kraft von Dampf), Robert Stirling, Britisches Patent Nr. 4081 von 1816.
[1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Ein wirtschaftlicher Motor zum Zwecke der Wasserf rderung durch die expansive Kraft von Dampf), Robert Stirling, Britisches Patent Nr. 4081 von 1816.
(ID 15362)
In der ersten Stufe der Anzahl der Mol ($n$) wird das Gas mit der Am System durchgeführte Arbeiten ($W_{in}$) von der Erweitertes Volumen ($V_1$) auf der Komprimiertes Volumen ($V_2$) isotherm auf die Temperatur im Zustand 1 ($T_1$) mit der Anzahl der Mol ($n$) und die Druck ($p$) berechnet, das von der Erweitertes Volumen ($V_1$) bis der Komprimiertes Volumen ($V_2$) in der Volumen ($V$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe von die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) mithilfe der Gasgleichung
| $ p V = n R_C T $ |
erhalten wird, ergibt sich das Integral f r die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15760)
In der zweiten Stufe wird der Wärme zugeführt ($Q_H$) hinzugef gt, was abh ngig von die Wärmekapazität bei konstantem Volumen ($C_V$) die Temperatur von die Temperatur im Zustand 1 ($T_1$) auf die Temperatur im Zustand 2 ($T_2$) erh ht:

Durch die Zufuhr von der Wärme zugeführt ($Q_H$) steigt die Temperatur des Gases von $T_2$ auf $T_3$ in einem isochoren Prozess (bei konstantem Volumen). Dies bedeutet, dass wir die Beziehung f r ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden k nnen, die durch die folgende Gleichung ausgedr ckt wird:
| $ dU = C_V \Delta T $ |
Dies f hrt zu den Werten von die Temperatur im Zustand 2 ($T_2$) und die Temperatur im Zustand 3 ($T_3$) wie folgt:
| $ Q_h = C_V ( T_2 - T_1 )$ |
(ID 15761)
In der dritten Stufe der Anzahl der Mol ($n$) dehnt sich das Gas auf der Vom System ausgeführte Arbeit ($W_{out}$) aus, w hrend sich das Volumen isotherm von der Komprimiertes Volumen ($V_2$) auf der Erweitertes Volumen ($V_1$) ausdehnt var>8490:

Die Arbeit wird durch die Integration von der Vom System ausgeführte Arbeit ($W_{out}$) mit die Druck ($p$) berechnet, die von ERROR:8458 bis der Erweitertes Volumen ($V_1$) in der Komprimiertes Volumen ($V_2$) integriert ist:
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Wenn die Druck ($p$) mit Hilfe der Gleichung f r Gase, n mlich
| $ p V = n R_C T $ |
durch die Universelle Gas Konstante ($R_C$), der Anzahl der Mol ($n$) und die Absolute Temperatur ($T$) erhalten wird, ergibt sich das Integral f r die Absolute Temperatur ($T$) als die Temperatur im Zustand 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Daher ergibt sich:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15762)
In der vierten Stufe wird der Absorbierte Wärme ($Q_C$) reduziert, wodurch, abh ngig von die Wärmekapazität bei konstantem Volumen ($C_V$), die Temperatur von die Temperatur im Zustand 2 ($T_2$) auf die Temperatur im Zustand 1 ($T_1$) sinkt :
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
Beim Entfernen von der Absorbierte Wärme ($Q_C$), wenn der Volumen ($V$) gleich ERROR:8498,0 ist, erh ht sich die Absolute Temperatur ($T$) von die Temperatur im Zustand 1 ($T_1$) auf die Temperatur im Zustand 2 ($T_2$). Dies impliziert, dass wir die Beziehung f r ERROR:8085 mit die Wärmekapazität bei konstantem Volumen ($C_V$) und die Variación de Temperature ($\Delta T$) verwenden k nnen, die durch die Gleichung ausgedr ckt wird:
| $ dU = C_V \Delta T $ |
dies f hrt uns zu dem Ausdruck:
| $ Q_c = C_V ( T_1 - T_2 )$ |
(ID 15763)
Die Leistungsfähigkeit ($\eta$) wird als das Verh ltnis von der Effektive Arbeit ($W$) zu der Wärme trug zum System bei ($Q$) definiert:
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
wobei der Effektive Arbeit ($W$) in Beziehung zu der Vom System ausgeführte Arbeit ($W_{out}$) und der Am System durchgeführte Arbeiten ($W_{in}$) steht durch:
| $ W \equiv W_{out} - W_{in} $ |
w hrend der Wärme trug zum System bei ($Q$) mit der Wärme zugeführt ($Q_H$) verbunden ist, was wie folgt definiert wird:
| $ Q \equiv W_{in} + Q_h $ |
Da der Vom System ausgeführte Arbeit ($W_{out}$) in Beziehung zu der Anzahl der Mol ($n$), die Temperatur im Zustand 2 ($T_2$), der Erweitertes Volumen ($V_1$), der Komprimiertes Volumen ($V_2$) und die Universelle Gas Konstante ($R_C$) steht durch:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Am System durchgeführte Arbeiten ($W_{in}$) mit die Temperatur im Zustand 1 ($T_1$) verbunden ist durch:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
und der Wärme zugeführt ($Q_H$) mit die Wärmekapazität bei konstantem Volumen ($C_V$) verbunden ist durch:
| $ Q_h = C_V ( T_2 - T_1 )$ |
kann die Leistungsfähigkeit ($\eta$) berechnet werden, was zu folgendem Ergebnis f hrt:
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
(ID 15764)
(ID 15343)
Das hinzuzuf gende der Wärme zugeführt ($Q_H$) h ngt von die Wärmekapazität bei konstantem Volumen ($C_V$) und dem Temperaturunterschied von die Temperatur im Zustand 1 ($T_1$) zu die Temperatur im Zustand 2 ($T_2$) ab:
| $ Q_h = C_V ( T_2 - T_1 )$ |
(ID 15363)
Der Vom System ausgeführte Arbeit ($W_{out}$) ist mit der Anzahl der Mol ($n$), die Universelle Gas Konstante ($R_C$), die Temperatur im Zustand 2 ($T_2$), der Erweitertes Volumen ($V_1$) und der Komprimiertes Volumen ($V_2$) gleich:
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15366)
Das hinzuzuf gende der Absorbierte Wärme ($Q_C$) h ngt von die Wärmekapazität bei konstantem Volumen ($C_V$) und dem Temperaturunterschied von die Temperatur im Zustand 2 ($T_2$) zu die Temperatur im Zustand 1 ($T_1$) ab:
| $ Q_c = C_V ( T_1 - T_2 )$ |
(ID 15364)
Der Am System durchgeführte Arbeiten ($W_{in}$) ist mit der Anzahl der Mol ($n$), die Universelle Gas Konstante ($R_C$), die Temperatur im Zustand 1 ($T_1$), der Erweitertes Volumen ($V_1$) und der Komprimiertes Volumen ($V_2$) gleich:
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15365)
Der Effektive Arbeit ($W$) besteht aus der Am System durchgeführte Arbeiten ($W_{in}$) und der Vom System ausgeführte Arbeit ($W_{out}$):
| $ W \equiv W_{out} - W_{in} $ |
.
(ID 15758)
Der Wärme trug zum System bei ($Q$) besteht aus der Wärme zugeführt ($Q_H$) und der Am System durchgeführte Arbeiten ($W_{in}$):
| $ Q \equiv W_{in} + Q_h $ |
.
(ID 15757)
Die Leistungsfähigkeit ($\eta$) kann als der Prozentsatz definiert werden, den der Effektive Arbeit ($W$) in der Wärme trug zum System bei ($Q$) darstellt:
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
.
(ID 15756)
Die Leistungsfähigkeit ($\eta$) des Stirling-Zyklus h ngt von die Temperatur im Zustand 1 ($T_1$), die Temperatur im Zustand 2 ($T_2$), der Erweitertes Volumen ($V_1$), der Komprimiertes Volumen ($V_2$), die Wärmekapazität bei konstantem Volumen ($C_V$), der Anzahl der Mol ($n$) und die Universelle Gas Konstante ($R_C$):
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
.
(ID 15759)
ID:(1485, 0)
