Der Carnot-Zyklus
Storyboard 
Der Carnot-Zyklus ist ein allgemeiner Zyklus im Druck-Volumen-Raum, der zeigt, wie im Prinzip eine thermodynamische Maschine gebaut werden kann, die den Wärmefluss in mechanische Arbeit umwandelt.
ID:(1488, 0)
Mechanismen
Konzept 
Der Zyklus besteht aus vier reversiblen Prozessen: zwei isothermen (konstante Temperatur) und zwei adiabatischen (kein Wärmeaustausch). Während der isothermen Expansion absorbiert das System (typischerweise ein Gas) Wärme aus einem Hochtemperaturreservoir, expandiert und verrichtet Arbeit an der Umgebung. Dies wird gefolgt von einer adiabatischen Expansion, bei der das System weiterhin Arbeit verrichtet, aber ohne Wärmeaustausch, was zu einer Abkühlung führt. Anschließend durchläuft das Gas eine isotherme Kompression, gibt Wärme an ein kühleres Reservoir ab, während am Gas gearbeitet wird, um es zu komprimieren. Der Zyklus endet mit einer adiabatischen Kompression, die die Temperatur des Gases weiter erhöht und es in seinen ursprünglichen Zustand zurückführt.
Die Schönheit des Carnot-Zyklus liegt in seiner Einfachheit und der Einsicht, die er in die Effizienzgrenzen aller wärmebasierten Motoren bietet. Die Effizienz eines Carnot-Motors hängt nur von den Temperaturen der heißen und kalten Reservoirs ab und ist unabhängig von der Arbeitssubstanz oder den Details des Prozesses selbst. Diese Effizienz wird als das Verhältnis der Temperaturdifferenz zwischen den Reservoirs zur höheren Temperatur ausgedrückt, was zeigt, dass kein realer Motor, der zwischen zwei Wärmereservoirs arbeitet, effizienter sein kann als ein Carnot-Motor, der zwischen denselben Reservoirs arbeitet.
ID:(15281, 0)
Carnot-Zyklus: Schema einer Maschine
Konzept 
In einer Maschine, die das Konzept von Carnot verwendet, finden folgende Prozesse statt:
• Der Reservoir mit der höheren Temperatur wird mit einem Ofen erzeugt.
• Der Reservoir mit der niedrigeren Temperatur wird durch ein Kühlsystem erzeugt.
• Der aus dem Reservoir erzeugte Dampf expandiert zu einem Gas, wodurch der Kolben verdrängt wird und die Ausgleichsmasse angehoben wird. In der ersten isothermen Phase ist das erste Ventil geöffnet, während das zweite Ventil geschlossen ist. In der zweiten Phase des Prozesses wird das erste Ventil geschlossen, und die Expansion erfolgt adiabatisch.
• In der dritten Phase wird das zweite Ventil geöffnet und mit Hilfe der Ausgleichsmasse wird der Kolben zurückgeführt und das Gas isotherm ausgestoßen. In der vierten Phase wird das Ventil geschlossen, und der Prozess endet adiabatisch.
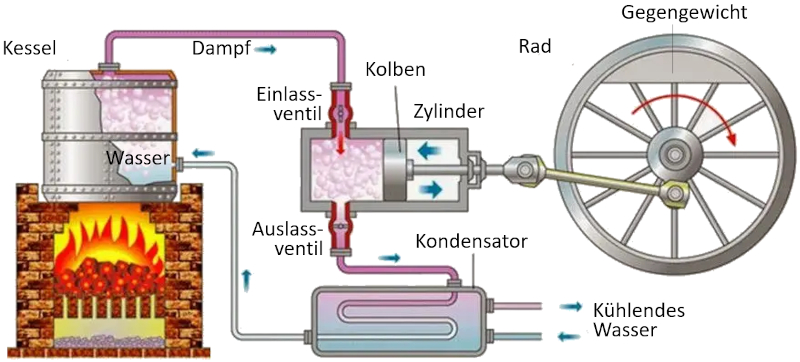
ID:(11134, 0)
Carnot-Zyklus
Konzept 
Sadi Carnot führte [1] das theoretische Konzept der ersten Maschinenkonstruktion ein, die auf einem Temperaturgradienten basierend mechanische Arbeit erzeugen kann. Dies wird durch einen Prozess im Druck-Volumen-Raum erreicht, bei dem Wärme hinzugefügt und extrahiert wird, wie in der Abbildung dargestellt:
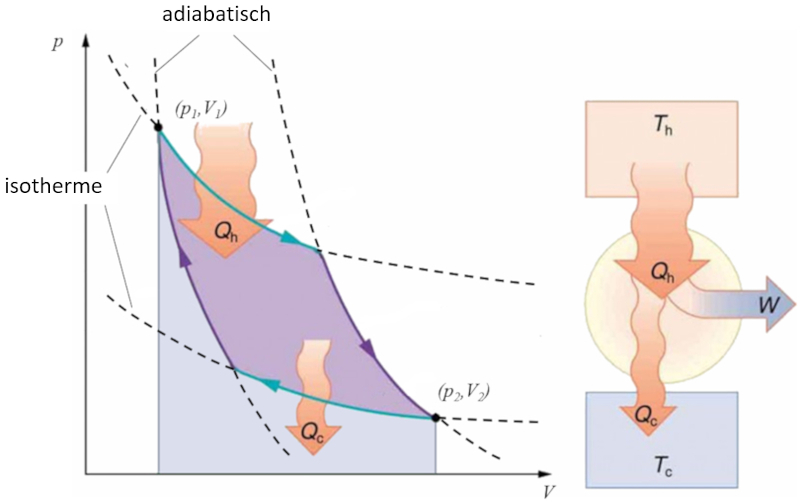
Die Fläche unter der Kurve der Wärme zugeführt ($Q_H$), die von 1 bis 2 reicht, repräsentiert die erforderliche Energiezufuhr, um vom Zustand ($p_1, V_1$) zum Zustand ($p_2, V_2$) überzugehen. Umgekehrt repräsentiert die Fläche unter der Kurve der Absorbierte Wärme ($Q_C$), die von 2 bis 1 verläuft, die benötigte Energieentnahme, um vom Zustand ($p_2, V_2$) zurück zum Zustand ($p_1, V_1$) zu gelangen. Die Differenz zwischen diesen Flächen entspricht dem von beiden Kurven umschlossenen Bereich und repräsentiert der Effektive Arbeit ($W$), den das System ausführen kann.
Carnot zeigte auch, dass gemäß dem zweiten Hauptsatz der Thermodynamik der Wärme zugeführt ($Q_H$) nicht null sein kann. Dies impliziert, dass es keine Maschinen gibt, die in der Lage sind, die gesamte Wärme in Arbeit umzuwandeln.![]() [1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexionen über die Triebkraft des Feuers und über Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, S. 393-457 (1872)
[1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance" (Reflexionen über die Triebkraft des Feuers und über Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, S. 393-457 (1872)
ID:(11131, 0)
Anwendung im einfachen Druck-Volumen-Diagramm
Konzept 
Der Carnot-Prozess wird einfach als ein Zyklus beschrieben, bei dem abwechselnd isotherm und adiabatisch gearbeitet wird. Insbesondere werden Druck-Volumen- und Temperatur-Entropie-Diagramme untersucht. Im ersten Fall können die vier Stufen wie folgt identifiziert werden:
Stufe 1 zu 2: Isotherme Expansion.
Stufe 2 zu 3: Adiabatische Expansion.
Stufe 3 zu 4: Isotherme Kompression.
Stufe 4 zu 1: Adiabatische Kompression.
Diese Stufen sind unten dargestellt:
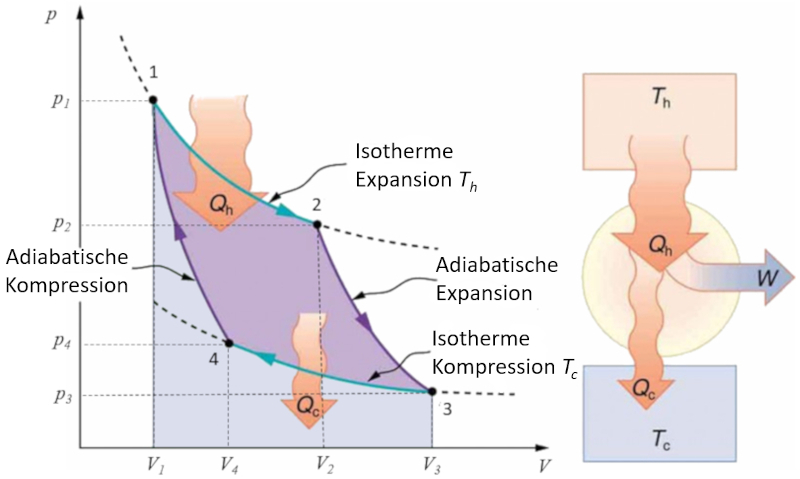
Das beigefügte Diagramm veranschaulicht den Energiefluss, wobei der Wärme zugeführt ($Q_H$) (heiß) das Reservoir bei die Hohe Temperatur ($T_H$) verlässt, in das System eintritt, Arbeit $W$ verrichtet, während das komplementäre ERROR:8171,0 (kalt) vom Reservoir bei die Niedrige Temperatur ($T_C$) aufgenommen wird.
ID:(11132, 0)
Anwendung im einfachen Temperatur-Entropie-Diagramm
Konzept 
Der Carnot-Zyklus wird einfach als ein Zyklus beschrieben, bei dem abwechselnd isotherm und adiabatisch gearbeitet wird. Insbesondere werden die Druck-Volumen- und Temperatur-Entropie-Diagramme untersucht. Im Fall des Temperatur-Entropie-Diagramms wird das Diagramm vereinfacht, indem von isothermen Stadien zu konstanten Entropie-Stadien übergegangen wird:
Im Temperatur-Entropie-Diagramm werden die konstanten Entropie-Stadien wie folgt dargestellt:
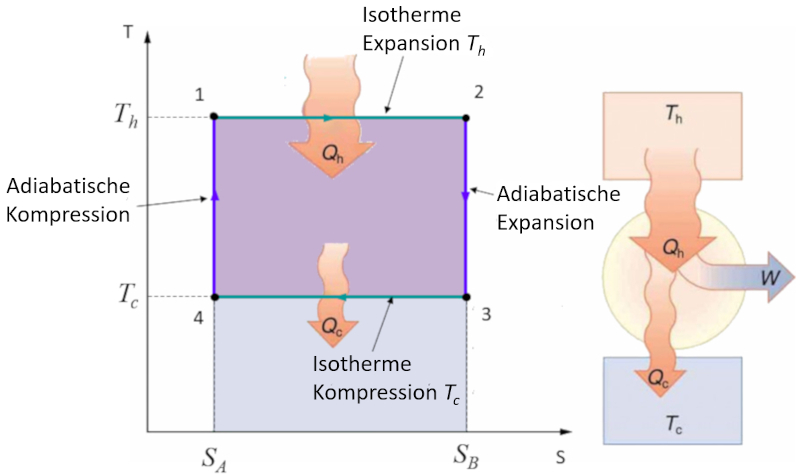
Während dieser Phasen bleibt die Entropie ($S$) konstant, was bedeutet, dass keine Wärmeübertragung stattfindet, während die Absolute Temperatur ($T$) variieren kann. Dies vereinfacht die Darstellung des Zyklus und ermöglicht eine direktere Analyse der thermodynamischen Eigenschaften des Systems.
ID:(11133, 0)
Ausgeführte Arbeit
Konzept 
Da der Differential ungenaue Arbeits ($\delta W$) in Abhängigkeit von die Druck ($p$) und die Volumenvariation ($\Delta V$) wie folgt definiert ist:
| $ \delta W = p dV $ |
Können wir der Effektive Arbeit ($W$) berechnen, indem wir entlang der Kurven des Zyklusdiagramms integrieren:
$W = \displaystyle\oint pdV$
Mit Hilfe des ersten Hauptsatzes der Thermodynamik mit der Interne Energiedifferenz ($dU$) und der Differential ungenau Wärme ($\delta Q$) ergibt sich:
| $ dU = \delta Q - \delta W $ |
Und unter Berücksichtigung des Pfads im Diagramm von die Absolute Temperatur ($T$) und die Entropie ($S$) erhalten wir mit die Entropievariation ($dS$):
$W = \displaystyle\oint pdV =\displaystyle\oint (\delta Q - dU) = \displaystyle\oint (TdS - dU) = \displaystyle\oint TdS - \displaystyle\oint dU$
Da das Integral entlang eines geschlossenen Pfads eines exakten Differentials gleich null ist, ergibt sich:
| $ W = \displaystyle\oint T dS$ |
ID:(10264, 0)
Leistung basierend auf Wärmeströme
Konzept 
Da die Leistungsfähigkeit ($\eta$) mit der Effektive Arbeit ($W$) und der Wärme zugeführt ($Q_H$) ist
| $ \eta \equiv \displaystyle\frac{ W }{ Q_H } $ |
kann es mit der Effektive Arbeit ($W$), das zusammen mit der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$) steht, ersetzt werden und ergibt
| $ W = Q_H - Q_C $ |
und liefert die folgende Beziehung:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
ID:(10262, 0)
Leistung abhängig von den Temperaturen
Konzept 
Die Leistungsfähigkeit ($\eta$) ist eine Funktion von der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$), gegeben durch:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Wir können der Wärme zugeführt ($Q_H$) in Bezug auf die Niedrige Temperatur ($T_C$), die Niedrige Entropie ($S_C$) und die Hohe Entropie ($S_H$) ausdrücken als:
| $ Q_C = T_C ( S_H - S_C ) $ |
Und unter Verwendung von die Hohe Temperatur ($T_H$) als:
| $ Q_H = T_H ( S_H - S_C ) $ |
Wenn wir diese Ausdrücke ersetzen, erhalten wir:
| $ \eta = 1 - \displaystyle\frac{ T_C }{ T_H } $ |
ID:(10260, 0)
Der Carnot-Zyklus
Modell 
Der Carnot-Zyklus ist ein allgemeiner Zyklus im Druck-Volumen-Raum, der zeigt, wie im Prinzip eine thermodynamische Maschine gebaut werden kann, die den Wärmefluss in mechanische Arbeit umwandelt.
Variablen
Berechnungen
Berechnungen
Gleichungen
(ID 11135)
Die Leistungsfähigkeit ($\eta$) ist eine Funktion von der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$), gegeben durch:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Wir k nnen der Wärme zugeführt ($Q_H$) in Bezug auf die Niedrige Temperatur ($T_C$), die Niedrige Entropie ($S_C$) und die Hohe Entropie ($S_H$) ausdr cken als:
| $ Q_C = T_C ( S_H - S_C ) $ |
Und unter Verwendung von die Hohe Temperatur ($T_H$) als:
| $ Q_H = T_H ( S_H - S_C ) $ |
Wenn wir diese Ausdr cke ersetzen, erhalten wir:
| $ \eta = 1 - \displaystyle\frac{ T_C }{ T_H } $ |
(ID 11136)
Da der Effektive Arbeit ($W$) gleich dem Integral entlang eines geschlossenen Pfads im Raum die Absolute Temperatur ($T$) und die Entropie ($S$) ist, haben wir:
| $ W = \displaystyle\oint T dS$ |
Beim Konsultieren des Temperatur-Entropie-Diagramms sehen wir, dass die aufgenommene W rme der Wärme zugeführt ($Q_H$) aufgrund der Differenz in der Entropie gleich die Hohe Temperatur ($T_H$) ist, n mlich die Hohe Entropie ($S_H$) und die Niedrige Entropie ($S_C$):
| $ Q_H = T_H ( S_H - S_C ) $ |
(ID 11137)
Da der Effektive Arbeit ($W$) gleich dem Integral entlang eines geschlossenen Pfads im Raum die Absolute Temperatur ($T$) und die Entropie ($S$) ist, haben wir:
| $ W = \displaystyle\oint T dS$ |
Bei Betrachtung des Temperatur-Entropie-Diagramms sehen wir, dass die aufgenommene W rme der Absorbierte Wärme ($Q_C$) aufgrund der Differenz in der Entropie gleich die Niedrige Temperatur ($T_C$) ist, n mlich die Hohe Entropie ($S_H$) und die Niedrige Entropie ($S_C$):
| $ Q_C = T_C ( S_H - S_C ) $ |
(ID 11138)
Da die Leistungsfähigkeit ($\eta$) mit der Effektive Arbeit ($W$) und der Wärme zugeführt ($Q_H$) ist
| $ \eta \equiv \displaystyle\frac{ W }{ Q_H } $ |
kann es mit der Effektive Arbeit ($W$), das zusammen mit der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$) steht, ersetzt werden und ergibt
| $ W = Q_H - Q_C $ |
und liefert die folgende Beziehung:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
(ID 11155)
Beispiele
Der Zyklus besteht aus vier reversiblen Prozessen: zwei isothermen (konstante Temperatur) und zwei adiabatischen (kein W rmeaustausch). W hrend der isothermen Expansion absorbiert das System (typischerweise ein Gas) W rme aus einem Hochtemperaturreservoir, expandiert und verrichtet Arbeit an der Umgebung. Dies wird gefolgt von einer adiabatischen Expansion, bei der das System weiterhin Arbeit verrichtet, aber ohne W rmeaustausch, was zu einer Abk hlung f hrt. Anschlie end durchl uft das Gas eine isotherme Kompression, gibt W rme an ein k hleres Reservoir ab, w hrend am Gas gearbeitet wird, um es zu komprimieren. Der Zyklus endet mit einer adiabatischen Kompression, die die Temperatur des Gases weiter erh ht und es in seinen urspr nglichen Zustand zur ckf hrt.
Die Sch nheit des Carnot-Zyklus liegt in seiner Einfachheit und der Einsicht, die er in die Effizienzgrenzen aller w rmebasierten Motoren bietet. Die Effizienz eines Carnot-Motors h ngt nur von den Temperaturen der hei en und kalten Reservoirs ab und ist unabh ngig von der Arbeitssubstanz oder den Details des Prozesses selbst. Diese Effizienz wird als das Verh ltnis der Temperaturdifferenz zwischen den Reservoirs zur h heren Temperatur ausgedr ckt, was zeigt, dass kein realer Motor, der zwischen zwei W rmereservoirs arbeitet, effizienter sein kann als ein Carnot-Motor, der zwischen denselben Reservoirs arbeitet.
(ID 15281)
In einer Maschine, die das Konzept von Carnot verwendet, finden folgende Prozesse statt:
• Der Reservoir mit der h heren Temperatur wird mit einem Ofen erzeugt.
• Der Reservoir mit der niedrigeren Temperatur wird durch ein K hlsystem erzeugt.
• Der aus dem Reservoir erzeugte Dampf expandiert zu einem Gas, wodurch der Kolben verdr ngt wird und die Ausgleichsmasse angehoben wird. In der ersten isothermen Phase ist das erste Ventil ge ffnet, w hrend das zweite Ventil geschlossen ist. In der zweiten Phase des Prozesses wird das erste Ventil geschlossen, und die Expansion erfolgt adiabatisch.
• In der dritten Phase wird das zweite Ventil ge ffnet und mit Hilfe der Ausgleichsmasse wird der Kolben zur ckgef hrt und das Gas isotherm ausgesto en. In der vierten Phase wird das Ventil geschlossen, und der Prozess endet adiabatisch.

(ID 11134)
Sadi Carnot f hrte [1] das theoretische Konzept der ersten Maschinenkonstruktion ein, die auf einem Temperaturgradienten basierend mechanische Arbeit erzeugen kann. Dies wird durch einen Prozess im Druck-Volumen-Raum erreicht, bei dem W rme hinzugef gt und extrahiert wird, wie in der Abbildung dargestellt:

Die Fl che unter der Kurve der Wärme zugeführt ($Q_H$), die von 1 bis 2 reicht, repr sentiert die erforderliche Energiezufuhr, um vom Zustand ($p_1, V_1$) zum Zustand ($p_2, V_2$) berzugehen. Umgekehrt repr sentiert die Fl che unter der Kurve der Absorbierte Wärme ($Q_C$), die von 2 bis 1 verl uft, die ben tigte Energieentnahme, um vom Zustand ($p_2, V_2$) zur ck zum Zustand ($p_1, V_1$) zu gelangen. Die Differenz zwischen diesen Fl chen entspricht dem von beiden Kurven umschlossenen Bereich und repr sentiert der Effektive Arbeit ($W$), den das System ausf hren kann.
Carnot zeigte auch, dass gem dem zweiten Hauptsatz der Thermodynamik der Wärme zugeführt ($Q_H$) nicht null sein kann. Dies impliziert, dass es keine Maschinen gibt, die in der Lage sind, die gesamte W rme in Arbeit umzuwandeln.![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexionen ber die Triebkraft des Feuers und ber Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, S. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexionen ber die Triebkraft des Feuers und ber Maschinen zur Entwicklung dieser Triebkraft), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, S. 393-457 (1872)
(ID 11131)
Der Carnot-Prozess wird einfach als ein Zyklus beschrieben, bei dem abwechselnd isotherm und adiabatisch gearbeitet wird. Insbesondere werden Druck-Volumen- und Temperatur-Entropie-Diagramme untersucht. Im ersten Fall k nnen die vier Stufen wie folgt identifiziert werden:
Stufe 1 zu 2: Isotherme Expansion.
Stufe 2 zu 3: Adiabatische Expansion.
Stufe 3 zu 4: Isotherme Kompression.
Stufe 4 zu 1: Adiabatische Kompression.
Diese Stufen sind unten dargestellt:

Das beigef gte Diagramm veranschaulicht den Energiefluss, wobei der Wärme zugeführt ($Q_H$) (hei ) das Reservoir bei die Hohe Temperatur ($T_H$) verl sst, in das System eintritt, Arbeit $W$ verrichtet, w hrend das komplement re ERROR:8171,0 (kalt) vom Reservoir bei die Niedrige Temperatur ($T_C$) aufgenommen wird.
(ID 11132)
Der Carnot-Zyklus wird einfach als ein Zyklus beschrieben, bei dem abwechselnd isotherm und adiabatisch gearbeitet wird. Insbesondere werden die Druck-Volumen- und Temperatur-Entropie-Diagramme untersucht. Im Fall des Temperatur-Entropie-Diagramms wird das Diagramm vereinfacht, indem von isothermen Stadien zu konstanten Entropie-Stadien bergegangen wird:
Im Temperatur-Entropie-Diagramm werden die konstanten Entropie-Stadien wie folgt dargestellt:

W hrend dieser Phasen bleibt die Entropie ($S$) konstant, was bedeutet, dass keine W rme bertragung stattfindet, w hrend die Absolute Temperatur ($T$) variieren kann. Dies vereinfacht die Darstellung des Zyklus und erm glicht eine direktere Analyse der thermodynamischen Eigenschaften des Systems.
(ID 11133)
Da der Differential ungenaue Arbeits ($\delta W$) in Abh ngigkeit von die Druck ($p$) und die Volumenvariation ($\Delta V$) wie folgt definiert ist:
| $ \delta W = p dV $ |
K nnen wir der Effektive Arbeit ($W$) berechnen, indem wir entlang der Kurven des Zyklusdiagramms integrieren:
$W = \displaystyle\oint pdV$
Mit Hilfe des ersten Hauptsatzes der Thermodynamik mit der Interne Energiedifferenz ($dU$) und der Differential ungenau Wärme ($\delta Q$) ergibt sich:
| $ dU = \delta Q - \delta W $ |
Und unter Ber cksichtigung des Pfads im Diagramm von die Absolute Temperatur ($T$) und die Entropie ($S$) erhalten wir mit die Entropievariation ($dS$):
$W = \displaystyle\oint pdV =\displaystyle\oint (\delta Q - dU) = \displaystyle\oint (TdS - dU) = \displaystyle\oint TdS - \displaystyle\oint dU$
Da das Integral entlang eines geschlossenen Pfads eines exakten Differentials gleich null ist, ergibt sich:
| $ W = \displaystyle\oint T dS$ |
(ID 10264)
Da die Leistungsfähigkeit ($\eta$) mit der Effektive Arbeit ($W$) und der Wärme zugeführt ($Q_H$) ist
| $ \eta \equiv \displaystyle\frac{ W }{ Q_H } $ |
kann es mit der Effektive Arbeit ($W$), das zusammen mit der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$) steht, ersetzt werden und ergibt
| $ W = Q_H - Q_C $ |
und liefert die folgende Beziehung:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
(ID 10262)
Die Leistungsfähigkeit ($\eta$) ist eine Funktion von der Wärme zugeführt ($Q_H$) und der Absorbierte Wärme ($Q_C$), gegeben durch:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Wir k nnen der Wärme zugeführt ($Q_H$) in Bezug auf die Niedrige Temperatur ($T_C$), die Niedrige Entropie ($S_C$) und die Hohe Entropie ($S_H$) ausdr cken als:
| $ Q_C = T_C ( S_H - S_C ) $ |
Und unter Verwendung von die Hohe Temperatur ($T_H$) als:
| $ Q_H = T_H ( S_H - S_C ) $ |
Wenn wir diese Ausdr cke ersetzen, erhalten wir:
| $ \eta = 1 - \displaystyle\frac{ T_C }{ T_H } $ |
(ID 10260)
(ID 15340)
ID:(1488, 0)
