Le cycle de Stirling
Storyboard 
Une machine thermodynamique qui n'utilise pas de combustion interne, mais qui reçoit uniquement de la chaleur provenant de l'extérieur. Ce processus génère toujours le cycle classique dans l'espace pression-volume, ce qui permet de modéliser et de calculer l'efficacité obtenue.
ID:(1485, 0)
Mécanismes
Concept 
Le cycle de Stirling comprend quatre phases principales : chauffage, expansion, refroidissement et compression, réalisées dans un environnement scellé où un gaz tel que l'hélium ou l'hydrogène sert de fluide de travail.
Durant la phase de chauffage, le gaz est chauffé à volume constant, absorbant la chaleur d'une source externe, ce qui augmente sa température et sa pression. Cette phase est suivie par l'expansion, où le gaz chauffé se dilate et effectue un travail sur un piston ou un autre mécanisme, diminuant ainsi sa température et sa pression tout en convertissant la chaleur en énergie mécanique.
Ensuite, la phase de refroidissement intervient à volume constant. Ici, le gaz perd de la chaleur, ce qui réduit sa température et sa pression, le préparant pour la phase finale. Le régénérateur joue un rôle crucial en absorbant la chaleur du gaz, ce qui conserve l'énergie et améliore l'efficacité.
Le cycle se termine par la compression du gaz refroidi, qui nécessite moins d'énergie que celle produite pendant l'expansion. Cette compression augmente la température du gaz, bien que pas autant que lors de la phase de chauffage initiale, et le cycle recommence.
Le régénérateur est vital tout au long de ce processus, stockant la chaleur de la phase de refroidissement et la restituant pendant le chauffage, réutilisant ainsi l'énergie dans le système et augmentant considérablement l'efficacité thermique du moteur. Les moteurs Stirling sont appréciés pour leur fonctionnement silencieux et la flexibilité d'utiliser n'importe quelle source de chaleur, ce qui les rend adaptables et bénéfiques pour l'environnement dans diverses applications.
ID:(15284, 0)
Cycle de Carnot
Concept 
Sadi Carnot a introduit [1] le concept théorique du premier projet de machine capable de générer du travail mécanique basé sur un gradient de température. Cela est réalisé grâce à un processus dans l'espace pression-volume où la chaleur est ajoutée et extraite, comme illustré dans l'image :
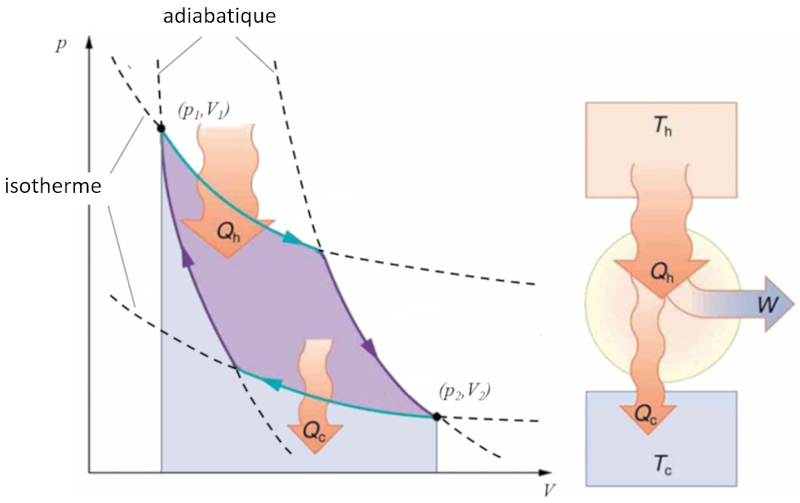
La zone sous la courbe le chaleur fournie ($Q_H$), s'étendant de 1 à 2, représente l'énergie nécessaire pour passer de l'état ($p_1, V_1$) à l'état ($p_2, V_2$). En revanche, la zone sous la courbe le chaleur absorbée ($Q_C$), allant de 2 à 1, représente l'extraction d'énergie nécessaire pour revenir de l'état ($p_2, V_2$) à l'état ($p_1, V_1$). La différence entre ces zones correspond à la région délimitée par les deux courbes et représente le travail efficace ($W$) que le système peut accomplir.
Carnot a également démontré que, conformément au deuxième principe de la thermodynamique, le chaleur fournie ($Q_H$) ne peut pas être nul. Cela implique qu'il n'existe pas de machines capables de convertir toute la chaleur en travail.![]() [1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance", Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
[1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance", Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
ID:(11131, 0)
Cycle d'Stirling : diagramme pression-volume
Concept 
Le cycle de Stirling [1] peut être considéré comme une solution technique basée sur le cycle de Carnot, qui se compose de quatre étapes bien définies :
Phase 1 à 2 : Compression isotherme $(p_1, V_1, T_1) \rightarrow (p_2, V_2, T_1)$.
Phase 2 à 3 : Chauffage isochore $(p_2, V_2, T_1) \rightarrow (p_3, V_2, T_2)$.
Phase 3 à 4 : Expansion isotherme $(p_3, V_2, T_2) \rightarrow (p_4, V_1, T_2)$.
Phase 4 à 1 : Refroidissement isochore $(p_4, V_1, T_2) \rightarrow (p_1, V_1, T_1)$.
Il est important de noter que ce cycle n'implique pas de phase adiabatique ; il repose plutôt sur l'échange entre des processus isochores (à volume constant) et des processus isothermes (à température constante).
Ces phases peuvent être visualisées dans le diagramme suivant :

![]() [1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Un moteur économique destiné à pomper de l'eau grâce à la force expansive de la vapeur), Robert Stirling, Brevet britannique n° 4081 de 1816.
[1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Un moteur économique destiné à pomper de l'eau grâce à la force expansive de la vapeur), Robert Stirling, Brevet britannique n° 4081 de 1816.
ID:(15362, 0)
Cycle Stirling 1 à 2
Concept 
Dans la première étape le nombre de taupes ($n$), le gaz est comprimé avec le travail effectué sur le système ($W_{in}$) de le volume étendu ($V_1$) à Le volume compressé ($V_2$) de manière isotherme jusqu'à A température à l'état 1 ($T_1$) avec le nombre de taupes ($n$) et a pression ($p$), intégrée en le volume ($V$), de le volume étendu ($V_1$) à Le volume compressé ($V_2$) :
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$) et a température absolue ($T$) avec l'équation des gaz
l'intégrale pour a température absolue ($T$) est égale à A température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par conséquent,
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
ID:(15760, 0)
Cycle Stirling 2 à 3
Concept 
Dans la deuxième étape, le chaleur fournie ($Q_H$) est ajouté qui, en fonction de a capacité thermique à volume constant ($C_V$), augmente la température de a température à l'état 1 ($T_1$) à A température à l'état 2 ($T_2$) :

En fournissant le chaleur fournie ($Q_H$), la température du gaz augmente de $T_2$ à $T_3$ dans un processus isochore (à volume constant). Cela signifie que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, exprimée par l'équation suivante :
| $ dU = C_V \Delta T $ |
Cela donne les valeurs de a température à l'état 2 ($T_2$) et a température à l'état 3 ($T_3$) comme suit :
| $ Q_h = C_V ( T_2 - T_1 )$ |
ID:(15761, 0)
Cycle Stirling 3 à 4
Concept 
Dans la troisième étape le nombre de taupes ($n$), le gaz se dilate pour former le travail effectué par le système ($W_{out}$) tandis que le volume passe de le volume compressé ($V_2$) à Le volume étendu ($V_1$) de manière isotherme jusqu'à <. var>8490 :

Le travail est calculé en utilisant l'intégrale de le travail effectué par le système ($W_{out}$) avec a pression ($p$), intégrée en le volume ($V$), de le volume étendu ($V_1$) à Le volume compressé ($V_2$) :
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$), et a température absolue ($T$) avec l'équation des gaz
| $ p V = n R_C T $ |
l'intégrale pour a température absolue ($T$) est égale à A température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par conséquent,
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
ID:(15762, 0)
Cycle Stirling 4 à 1
Concept 
Dans la quatrième étape, le chaleur absorbée ($Q_C$) est réduit, ce qui, en fonction de a capacité thermique à volume constant ($C_V$), diminue la température de a température à l'état 2 ($T_2$) à A température à l'état 1 ($T_1$) :
|
|
En éliminant le chaleur absorbée ($Q_C$) lorsque le volume ($V$) est égal à ERROR:8498,0, a température absolue ($T$) augmente de a température à l'état 1 ($T_1$) à A température à l'état 2 ($T_2$). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, qui est exprimée par l'équation :
| $ dU = C_V \Delta T $ |
cela nous mène à l'expression :
| $ Q_c = C_V ( T_1 - T_2 )$ |
ID:(15763, 0)
Performances du cycle de Stirling
Concept 
A efficacité ($\eta$) est défini comme le rapport de le travail efficace ($W$) à Le la chaleur a contribué au système ($Q$) :
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
où Le travail efficace ($W$) est en relation avec le travail effectué par le système ($W_{out}$) et le travail effectué sur le système ($W_{in}$) par :
| $ W \equiv W_{out} - W_{in} $ |
tandis que le la chaleur a contribué au système ($Q$) est associé à Le chaleur fournie ($Q_H$), ce qui est défini comme :
| $ Q \equiv W_{in} + Q_h $ |
Comme le travail effectué par le système ($W_{out}$) est en relation avec le nombre de taupes ($n$), a température à l'état 2 ($T_2$), le volume étendu ($V_1$), le volume compressé ($V_2$) et a constante du gaz universel ($R_C$) par :
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le travail effectué sur le système ($W_{in}$) est associé à A température à l'état 1 ($T_1$) par :
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le chaleur fournie ($Q_H$) est lié à A capacité thermique à volume constant ($C_V$) par :
| $ Q_h = C_V ( T_2 - T_1 )$ |
a efficacité ($\eta$) peut être calculé, ce qui donne :
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
ID:(15764, 0)
Le cycle de Stirling
Modèle 
Une machine thermodynamique qui n'utilise pas de combustion interne, mais qui reçoit uniquement de la chaleur provenant de l'extérieur. Ce processus génère toujours le cycle classique dans l'espace pression-volume, ce qui permet de modéliser et de calculer l'efficacité obtenue.
Variables
Calculs
Calculs
Équations
En fournissant le chaleur fournie ($Q_H$), la temp rature du gaz augmente de $T_2$ $T_3$ dans un processus isochore ( volume constant). Cela signifie que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, exprim e par l' quation suivante :
| $ dU = C_V \Delta T $ |
Cela donne les valeurs de a température à l'état 2 ($T_2$) et a température à l'état 3 ($T_3$) comme suit :
| $ Q_h = C_V ( T_2 - T_1 )$ |
(ID 15363)
En liminant le chaleur absorbée ($Q_C$) lorsque le volume ($V$) est gal ERROR:8498,0, a température absolue ($T$) augmente de a température à l'état 1 ($T_1$) A température à l'état 2 ($T_2$). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, qui est exprim e par l' quation :
| $ dU = C_V \Delta T $ |
cela nous m ne l'expression :
| $ Q_c = C_V ( T_1 - T_2 )$ |
(ID 15364)
Le travail est calcul l'aide de l'int grale de le travail effectué sur le système ($W_{in}$) avec le nombre de taupes ($n$) et a pression ($p$), int gr e en le volume ($V$), de le volume étendu ($V_1$) Le volume compressé ($V_2$) :
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$) et a température absolue ($T$) avec l' quation des gaz
| $ p V = n R_C T $ |
l'int grale pour a température absolue ($T$) est gale a température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par cons quent,
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15365)
Le travail est calcul en utilisant l'int grale de le travail effectué par le système ($W_{out}$) avec a pression ($p$), int gr e en le volume ($V$), de le volume étendu ($V_1$) Le volume compressé ($V_2$) :
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$), et a température absolue ($T$) avec l' quation des gaz
| $ p V = n R_C T $ |
l'int grale pour a température absolue ($T$) est gale a température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par cons quent,
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15366)
(ID 15757)
A efficacité ($\eta$) est d fini comme le rapport de le travail efficace ($W$) Le la chaleur a contribué au système ($Q$) :
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
o le travail efficace ($W$) est en relation avec le travail effectué par le système ($W_{out}$) et le travail effectué sur le système ($W_{in}$) par :
| $ W \equiv W_{out} - W_{in} $ |
tandis que le la chaleur a contribué au système ($Q$) est associ le chaleur fournie ($Q_H$), ce qui est d fini comme :
| $ Q \equiv W_{in} + Q_h $ |
Comme le travail effectué par le système ($W_{out}$) est en relation avec le nombre de taupes ($n$), a température à l'état 2 ($T_2$), le volume étendu ($V_1$), le volume compressé ($V_2$) et a constante du gaz universel ($R_C$) par :
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le travail effectué sur le système ($W_{in}$) est associ a température à l'état 1 ($T_1$) par :
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le chaleur fournie ($Q_H$) est li a capacité thermique à volume constant ($C_V$) par :
| $ Q_h = C_V ( T_2 - T_1 )$ |
a efficacité ($\eta$) peut tre calcul , ce qui donne :
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
(ID 15759)
Exemples
Le cycle de Stirling comprend quatre phases principales : chauffage, expansion, refroidissement et compression, r alis es dans un environnement scell o un gaz tel que l'h lium ou l'hydrog ne sert de fluide de travail.
Durant la phase de chauffage, le gaz est chauff volume constant, absorbant la chaleur d'une source externe, ce qui augmente sa temp rature et sa pression. Cette phase est suivie par l'expansion, o le gaz chauff se dilate et effectue un travail sur un piston ou un autre m canisme, diminuant ainsi sa temp rature et sa pression tout en convertissant la chaleur en nergie m canique.
Ensuite, la phase de refroidissement intervient volume constant. Ici, le gaz perd de la chaleur, ce qui r duit sa temp rature et sa pression, le pr parant pour la phase finale. Le r g n rateur joue un r le crucial en absorbant la chaleur du gaz, ce qui conserve l' nergie et am liore l'efficacit .
Le cycle se termine par la compression du gaz refroidi, qui n cessite moins d' nergie que celle produite pendant l'expansion. Cette compression augmente la temp rature du gaz, bien que pas autant que lors de la phase de chauffage initiale, et le cycle recommence.
Le r g n rateur est vital tout au long de ce processus, stockant la chaleur de la phase de refroidissement et la restituant pendant le chauffage, r utilisant ainsi l' nergie dans le syst me et augmentant consid rablement l'efficacit thermique du moteur. Les moteurs Stirling sont appr ci s pour leur fonctionnement silencieux et la flexibilit d'utiliser n'importe quelle source de chaleur, ce qui les rend adaptables et b n fiques pour l'environnement dans diverses applications.
(ID 15284)
Sadi Carnot a introduit [1] le concept th orique du premier projet de machine capable de g n rer du travail m canique bas sur un gradient de temp rature. Cela est r alis gr ce un processus dans l'espace pression-volume o la chaleur est ajout e et extraite, comme illustr dans l'image :

La zone sous la courbe le chaleur fournie ($Q_H$), s' tendant de 1 2, repr sente l' nergie n cessaire pour passer de l' tat ($p_1, V_1$) l' tat ($p_2, V_2$). En revanche, la zone sous la courbe le chaleur absorbée ($Q_C$), allant de 2 1, repr sente l'extraction d' nergie n cessaire pour revenir de l' tat ($p_2, V_2$) l' tat ($p_1, V_1$). La diff rence entre ces zones correspond la r gion d limit e par les deux courbes et repr sente le travail efficace ($W$) que le syst me peut accomplir.
Carnot a galement d montr que, conform ment au deuxi me principe de la thermodynamique, le chaleur fournie ($Q_H$) ne peut pas tre nul. Cela implique qu'il n'existe pas de machines capables de convertir toute la chaleur en travail.![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
(ID 11131)
Le cycle de Stirling [1] peut tre consid r comme une solution technique bas e sur le cycle de Carnot, qui se compose de quatre tapes bien d finies :
Phase 1 2 : Compression isotherme $(p_1, V_1, T_1) \rightarrow (p_2, V_2, T_1)$.
Phase 2 3 : Chauffage isochore $(p_2, V_2, T_1) \rightarrow (p_3, V_2, T_2)$.
Phase 3 4 : Expansion isotherme $(p_3, V_2, T_2) \rightarrow (p_4, V_1, T_2)$.
Phase 4 1 : Refroidissement isochore $(p_4, V_1, T_2) \rightarrow (p_1, V_1, T_1)$.
Il est important de noter que ce cycle n'implique pas de phase adiabatique ; il repose plut t sur l' change entre des processus isochores ( volume constant) et des processus isothermes ( temp rature constante).
Ces phases peuvent tre visualis es dans le diagramme suivant :

![]() [1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Un moteur conomique destin pomper de l'eau gr ce la force expansive de la vapeur), Robert Stirling, Brevet britannique n 4081 de 1816.
[1] "An Economical Engine for the Purpose of Pumping Water by the Expansive Force of Steam" (Un moteur conomique destin pomper de l'eau gr ce la force expansive de la vapeur), Robert Stirling, Brevet britannique n 4081 de 1816.
(ID 15362)
Dans la premi re tape le nombre de taupes ($n$), le gaz est comprim avec le travail effectué sur le système ($W_{in}$) de le volume étendu ($V_1$) Le volume compressé ($V_2$) de mani re isotherme jusqu' A température à l'état 1 ($T_1$) avec le nombre de taupes ($n$) et a pression ($p$), int gr e en le volume ($V$), de le volume étendu ($V_1$) Le volume compressé ($V_2$) :
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$) et a température absolue ($T$) avec l' quation des gaz
l'int grale pour a température absolue ($T$) est gale a température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_1}{V} dV = nRT_1\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par cons quent,
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15760)
Dans la deuxi me tape, le chaleur fournie ($Q_H$) est ajout qui, en fonction de a capacité thermique à volume constant ($C_V$), augmente la temp rature de a température à l'état 1 ($T_1$) A température à l'état 2 ($T_2$)xa0:

En fournissant le chaleur fournie ($Q_H$), la temp rature du gaz augmente de $T_2$ $T_3$ dans un processus isochore ( volume constant). Cela signifie que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, exprim e par l' quation suivante :
| $ dU = C_V \Delta T $ |
Cela donne les valeurs de a température à l'état 2 ($T_2$) et a température à l'état 3 ($T_3$) comme suit :
| $ Q_h = C_V ( T_2 - T_1 )$ |
(ID 15761)
Dans la troisi me tape le nombre de taupes ($n$), le gaz se dilate pour former le travail effectué par le système ($W_{out}$) tandis que le volume passe de le volume compressé ($V_2$) Le volume étendu ($V_1$) de mani re isotherme jusqu' <. var>8490xa0:

Le travail est calcul en utilisant l'int grale de le travail effectué par le système ($W_{out}$) avec a pression ($p$), int gr e en le volume ($V$), de le volume étendu ($V_1$) Le volume compressé ($V_2$) :
| $ W = \displaystyle\int_{V_1}^{V_2}p\,dV$ |
Si a pression ($p$) est obtenu en utilisant a constante du gaz universel ($R_C$), le nombre de taupes ($n$), et a température absolue ($T$) avec l' quation des gaz
| $ p V = n R_C T $ |
l'int grale pour a température absolue ($T$) est gale a température à l'état 1 ($T_1$).
$W = \displaystyle\int_{V_1}^{V_2} p dV = \displaystyle\int_{V_1}^{V_2} \displaystyle\frac{nRT_2}{V} dV = nRT_2\ln\left(\displaystyle\frac{V_2}{V_1}\right)$
Par cons quent,
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
(ID 15762)
Dans la quatri me tape, le chaleur absorbée ($Q_C$) est r duit, ce qui, en fonction de a capacité thermique à volume constant ($C_V$), diminue la temp rature de a température à l'état 2 ($T_2$) A température à l'état 1 ($T_1$) :
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
En liminant le chaleur absorbée ($Q_C$) lorsque le volume ($V$) est gal ERROR:8498,0, a température absolue ($T$) augmente de a température à l'état 1 ($T_1$) A température à l'état 2 ($T_2$). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, qui est exprim e par l' quation :
| $ dU = C_V \Delta T $ |
cela nous m ne l'expression :
| $ Q_c = C_V ( T_1 - T_2 )$ |
(ID 15763)
A efficacité ($\eta$) est d fini comme le rapport de le travail efficace ($W$) Le la chaleur a contribué au système ($Q$) :
| $ \eta \equiv \displaystyle\frac{ W }{ Q } $ |
o le travail efficace ($W$) est en relation avec le travail effectué par le système ($W_{out}$) et le travail effectué sur le système ($W_{in}$) par :
| $ W \equiv W_{out} - W_{in} $ |
tandis que le la chaleur a contribué au système ($Q$) est associ le chaleur fournie ($Q_H$), ce qui est d fini comme :
| $ Q \equiv W_{in} + Q_h $ |
Comme le travail effectué par le système ($W_{out}$) est en relation avec le nombre de taupes ($n$), a température à l'état 2 ($T_2$), le volume étendu ($V_1$), le volume compressé ($V_2$) et a constante du gaz universel ($R_C$) par :
| $ W_{out} = n R_C T_2 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le travail effectué sur le système ($W_{in}$) est associ a température à l'état 1 ($T_1$) par :
| $ W_{in} = n R_C T_1 \ln\left(\displaystyle\frac{ V_2 }{ V_1 }\right)$ |
et le chaleur fournie ($Q_H$) est li a capacité thermique à volume constant ($C_V$) par :
| $ Q_h = C_V ( T_2 - T_1 )$ |
a efficacité ($\eta$) peut tre calcul , ce qui donne :
| $ \eta = \displaystyle\frac{ T_2 - T_1 }{ T_1 + \displaystyle\frac{ C_V ( T_2 - T_1 )}{ n R_C \ln( V_2 / V_1 )}}$ |
(ID 15764)
(ID 15343)
ID:(1485, 0)
