Temperatura absoluta prática
Storyboard 
Variáveis
Cálculos
Cálculos
Equações
A lei de Charles estabelece que, com la pressão ($p$) constante, a propor o de o volume ($V$) com la temperatura absoluta ($T$) igual a la constante da lei de Charles ($C_c$):
Isso significa que se um g s passa de um estado inicial (o volume no estado i ($V_i$) e la temperatura no estado inicial ($T_i$)) para um estado final (o volume no estado f ($V_f$) e la temperatura no estado final ($T_f$)), mantendo la pressão ($p$) constante, ele deve sempre obedecer lei de Charles:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Portanto, temos:
Exemplos
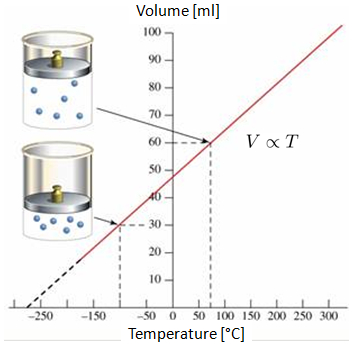
Se o volume de um g s for medido a 0 C e 100 C, observa-se um comportamento linear no gr fico de volume-temperatura. Se a reta for projetada, pode-se ver que em algum ponto das temperaturas negativas (na escala Celsius ou Fahrenheit), o volume atingir o valor zero. Esse ponto chamado de zero absoluto.
importante ressaltar que na realidade n o se alcan a a situa o em que o volume chega a zero, pois todos os gases condensam e solidificam muito antes de atingir o zero absoluto.
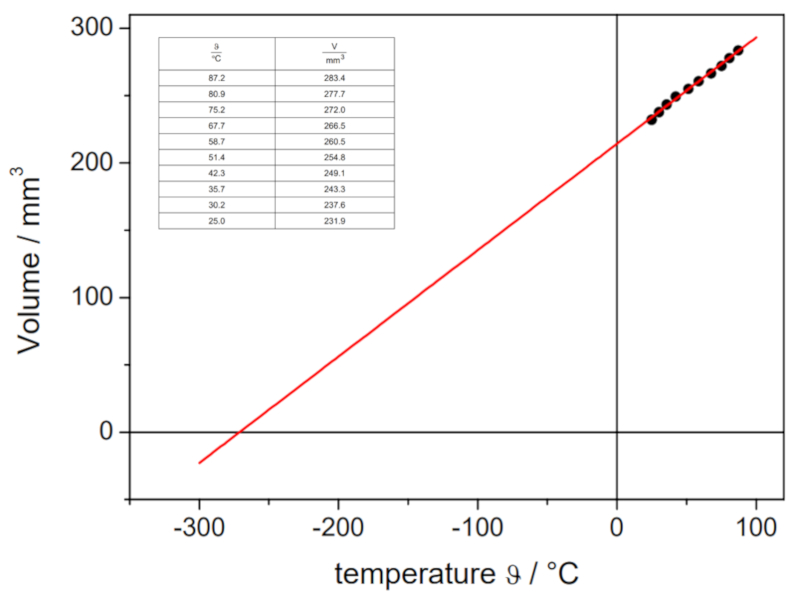
No seguinte v deo, mostrado como os volumes de um g s em diferentes temperaturas s o determinados no laborat rio, a fim de tra ar a curva de volume-temperatura em press o constante. Atrav s da interse o da reta com o eixo da temperatura, poss vel determinar a temperatura absoluta na qual teoricamente o volume deveria ser zero:
Os valores obtidos s o:
| V [ml] | T [C] |
| 152.1 | 3.7 |
| 165.1 | 21.9 |
| 183.1 | 43.0 |
Esses valores s o representados graficamente, incluindo a reta calculada por regress o:
Essa estimativa nos d um valor de -148 C, que difere do valor real de -273.15 C.
A lei de Charles estabelece uma rela o entre o volume ($V$) e la temperatura absoluta ($T$), indicando que sua propor o igual a la constante da lei de Charles ($C_c$), da seguinte forma:
A lei de Charles estabelece uma rela o entre o volume ($V$) e la temperatura absoluta ($T$), indicando que sua propor o igual a la constante da lei de Charles ($C_c$), da seguinte forma:
Se um g s passa de um estado inicial (i) para um estado final (f) com la pressão ($p$) constante, ent o para o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$) v lido:
ID:(1478, 0)