Práctico Temperatura Absoluta
Storyboard 
Mediante la ley de Charles se puede estimar la temperatura del cero absoluto. Para ello se contrae un volumen de gas a 100C a 0C y con ambos volúmenes y temperaturas se puede mediante la ley de Charles estimar el cero absoluto.
ID:(1478, 0)
Práctico Temperatura Absoluta
Storyboard 
Mediante la ley de Charles se puede estimar la temperatura del cero absoluto. Para ello se contrae un volumen de gas a 100C a 0C y con ambos volúmenes y temperaturas se puede mediante la ley de Charles estimar el cero absoluto.
Variables
Cálculos
Cálculos
Ecuaciones
La ley de Charles establece que, con la presión ($p$) constante, se cumple que la proporci n de el volumen ($V$) con la temperatura absoluta ($T$) es igual a la constante de la ley de Charles ($C_c$):
Esto significa que si un gas pasa de un estado inicial (el volumen en estado i ($V_i$) y la temperatura en estado inicial ($T_i$)) a un estado final (el volumen en estado f ($V_f$) y la temperatura en estado final ($T_f$)), manteniendo la presión ($p$) constante, debe siempre cumplir la ley de Charles:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Por lo tanto, se tiene que:
Ejemplos
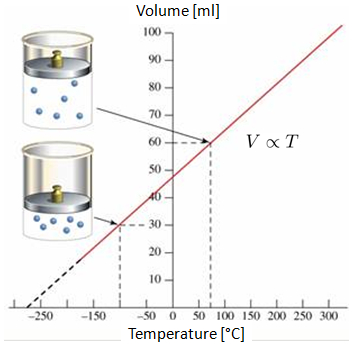
Si se mide el volumen de un gas a temperatura 0 C y a 100 C, se observa un comportamiento lineal en el gr fico volumen-temperatura. Si se proyecta la recta, se puede ver que en alg n punto de las temperaturas negativas (en escala Celsius o Fahrenheit), el volumen alcanzar el volumen nulo. Este punto se denomina el cero absoluto.
Es importante destacar que en la realidad no se alcanza la situaci n en la que el volumen llega a cero, ya que todos los gases se condensan y se solidifican mucho antes de alcanzar el cero absoluto.
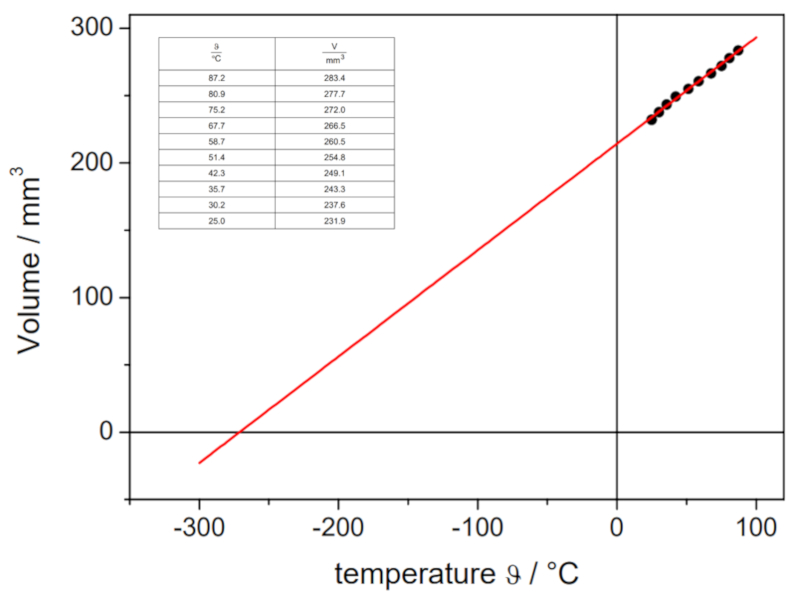
En el siguiente video se muestra c mo se determinan los vol menes de un gas a diferentes temperaturas en el laboratorio, con el fin de trazar la curva de volumen-temperatura a presi n constante. A trav s de la intersecci n de la recta con el eje de la temperatura, se puede determinar la temperatura absoluta te rica en la cual el volumen deber a ser cero:
Los valores obtenidos son:
| V [ml] | T [C] |
| 152.1 | 3.7 |
| 165.1 | 21.9 |
| 183.1 | 43.0 |
Estos valores se representan gr ficamente, incluyendo la recta calculada mediante regresi n:
Esta estimaci n nos arroja un valor de -148 C, el cual difiere del valor real de -273.15 C.
La ley de Charles establece una relaci n entre el volumen ($V$) y la temperatura absoluta ($T$), indicando que su proporcion es igual a la constante de la ley de Charles ($C_c$), de la siguiente manera:
La ley de Charles establece una relaci n entre el volumen ($V$) y la temperatura absoluta ($T$), indicando que su proporcion es igual a la constante de la ley de Charles ($C_c$), de la siguiente manera:
Si un gas pasa de un estado inicial (i) a un estado final (f) con la presión ($p$) constante, se cumple que para el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$):
ID:(1478, 0)