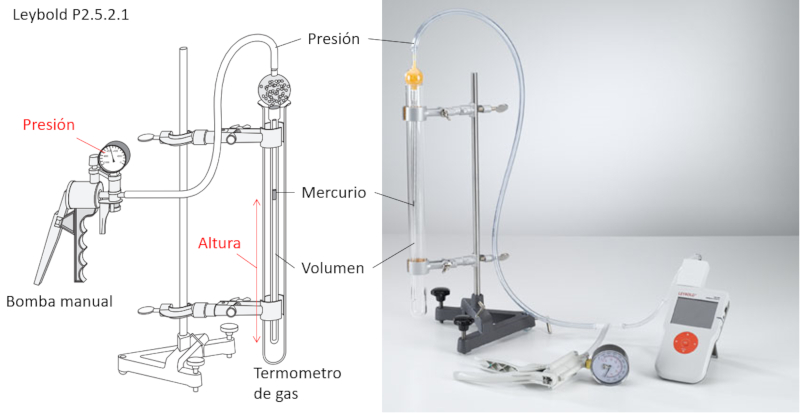
Experimento da lei de Boyle
Imagem 
Para estudar a lei de Boyle, são necessários os seguintes itens:
• Bomba de ar manual
• Termômetro de gás com volume controlado
O termômetro de gás é um tubo que contém em seu interior outro tubo conectado à bomba e que possui um pequeno volume de mercúrio.
Através do cilindro externo, é possível fixar a temperatura na qual o experimento será realizado.
À medida que a pressão é aumentada com a bomba, o mercúrio se desloca comprimindo o volume que ele encapsula. Dessa forma, é possível medir, para cada pressão, o volume associado, assegurando que a temperatura seja mantida constante.
Além disso, o mercúrio encapsula o volume, garantindo assim que o número de moles seja mantido constante.
ID:(11174, 0)
Experimento da lei de Boyle
Nota 
Se o experimento for realizado com uma temperatura e quantidade de moles de gás definidos, podem ser observados dados conforme listados e representados no seguinte gráfico:
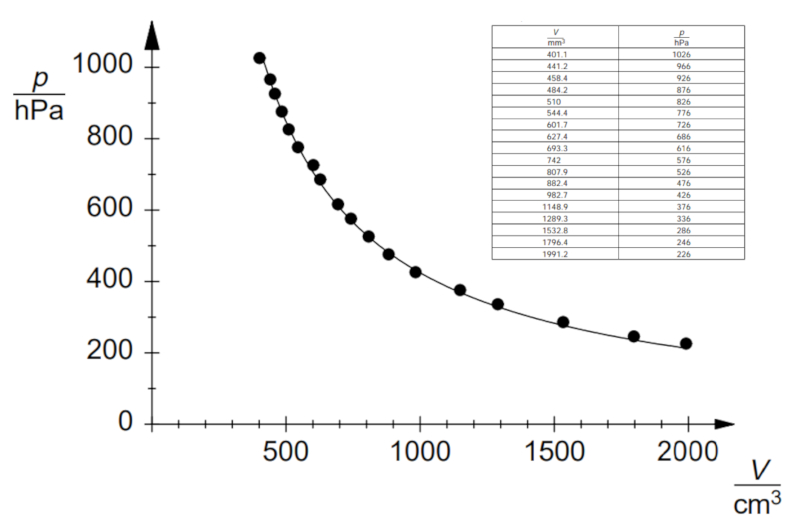
Isso demonstra a Lei de Boyle, que estabelece que a pressão $p$ e o volume $V$ variam inversamente de acordo com a seguinte relação:
ID:(11177, 0)
Experimento da lei de Charles
Citar 
Para estudar a lei de Charles, são necessários os seguintes equipamentos:
• Um termômetro de gás com volume controlado.
• Uma sonda de medição de temperatura.
Nesse caso, o cilindro interno do termômetro de gás pode ser deixado aberto, caso seja utilizado o pressão ambiente, ou pode ser selado com uma bomba para manter uma pressão definida.
Para realizar a medição, a temperatura é variada no cilindro externo do termômetro de gás, e o valor da temperatura é medido com a sonda.
Além disso, observa-se como o volume do mercúrio se desloca, aumentando ou reduzindo, o que também pode ser medido.
Adicionalmente, o mercúrio encapsula o volume, garantindo assim que o número de mols se mantenha constante.

ID:(11175, 0)
Experimento da Lei de Charles, Dados
Exercício 
Se o experimento for realizado com uma pressão e quantidade de moles de gás definidos, podem ser obtidos dados como os listados e representados no seguinte gráfico:
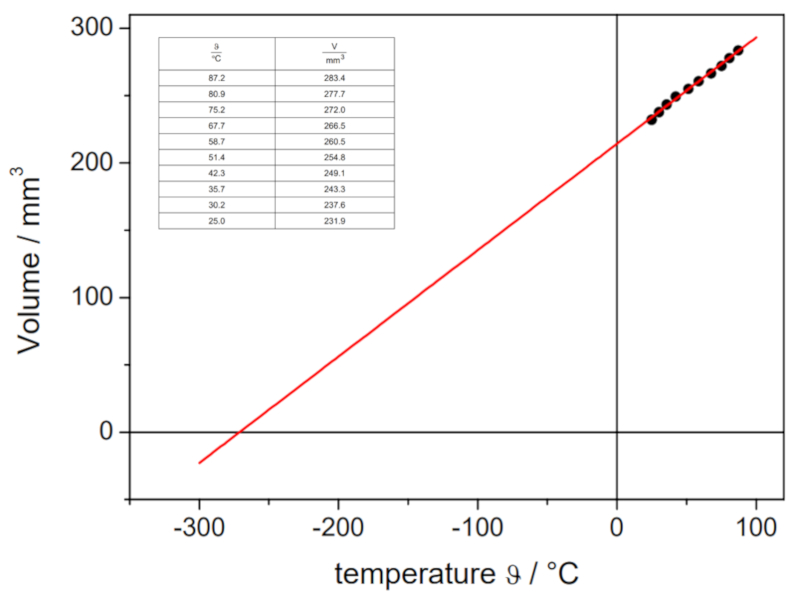
Isso ilustra a lei de Charles, que estabelece que a temperatura $T$ e o volume $V$ variam de forma proporcional de acordo com a seguinte relação:
ID:(11178, 0)
Experiência da lei de Gay Lussac
Equação 
Para estudar a lei de Gay-Lussac, são necessários os seguintes equipamentos:
• Bomba de ar manual
• Termômetro de gás com volume controlado
• Sonda de medição de temperatura
Nesse caso, trabalha-se com um volume pré-definido.
Para realizar a medição, varia-se a temperatura no cilindro externo do termômetro de gás e mede-se o valor da temperatura com a sonda.
Em seguida, modifica-se a pressão com uma bomba até que o volume atinja o valor pré-definido.
O experimento é repetido com outra temperatura, ajustando novamente a pressão para alcançar o mesmo volume.
Adicionalmente, o mercúrio encapsula o volume, garantindo que o número de moles se mantenha constante.

ID:(11176, 0)
Experimento da lei de Gay Lussac, dados
Script 
Se o experimento for realizado com um volume e quantidade de moles de gás definidos, podem ser obtidos dados como listados e representados no seguinte gráfico:
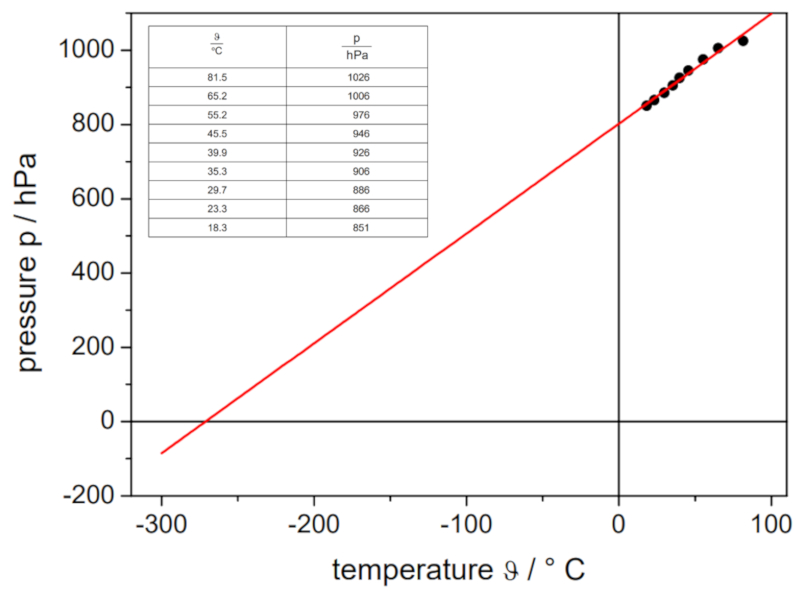
Isso ilustra a lei de Gay-Lussac, que estabelece que a temperatura $T$ e a pressão $p$ variam de forma proporcional de acordo com a seguinte relação:
ID:(11180, 0)
Bomba manual
Variable 
Para bombear gás, constrói-se um instrumento que contém uma câmara e um pistão com duas aberturas.
Cada vez que o pistão é retirado (succiona), o gás penetra na câmara de compressão através da abertura que está aberta, enquanto a de saída está fechada.
Em seguida, quando o pistão é movido para gerar pressão, ele se desloca com a abertura fechada, comprimindo o gás até que sua pressão supere a do sistema no qual se pretende injetar o gás. Nesse momento, a segunda abertura se abre, permitindo a saída do gás comprimido e contribuindo assim para continuar aumentando a pressão do sistema a ser comprimido.
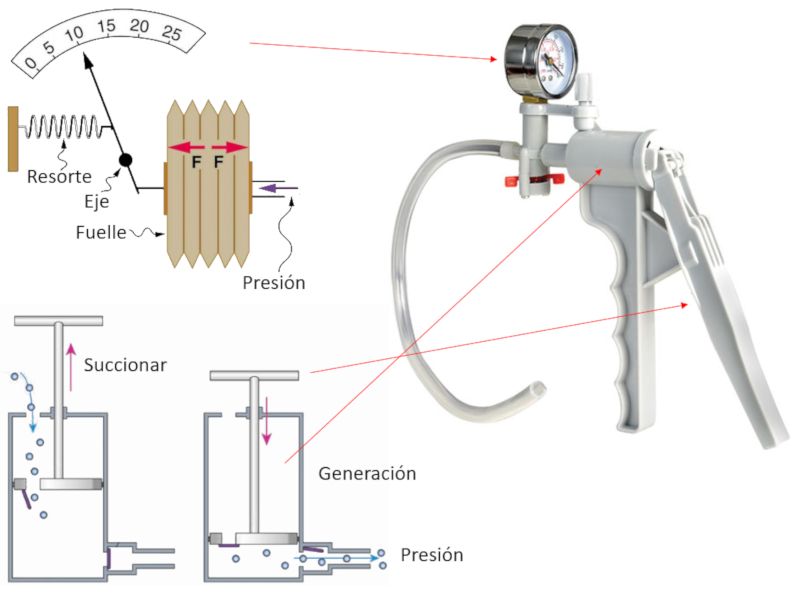
A pressão alcançada é medida mecanicamente, pois há uma membrana conectada a uma agulha que se move de acordo com esse deslocamento, indicando a pressão alcançada.
ID:(11181, 0)
Termômetro de gás
Audio 
O pistão preenchido com gás é mergulhado no líquido a ser medido, fazendo com que o gás se expanda ou contraia com a temperatura. A pressão do gás é equilibrada com a coluna de mercúrio, e a altura pode ser calibrada em função da temperatura:
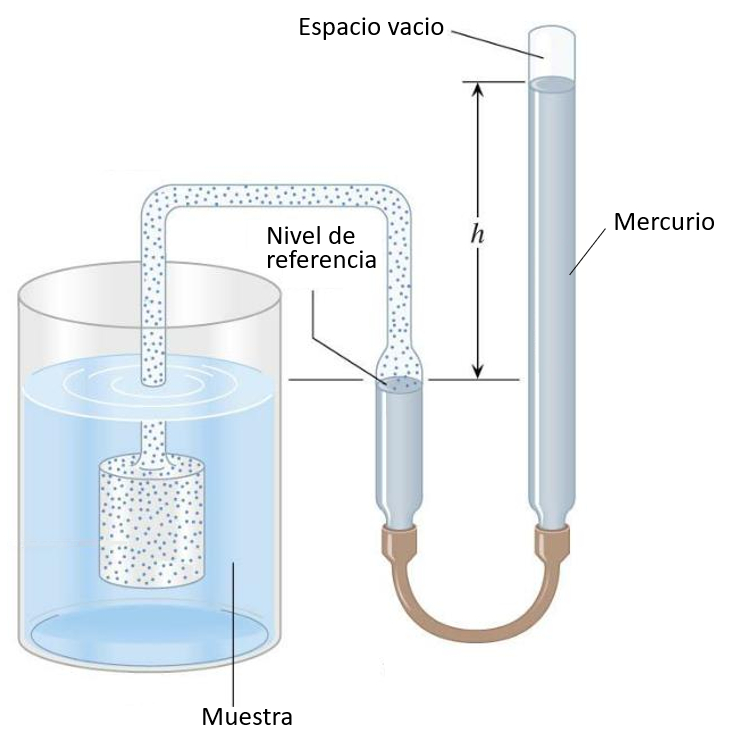
No caso de experimentos com gases, é utilizada uma câmara de vácuo para envolver o gás desejado no experimento. Em vez de usar um gás para medir a temperatura, ele é empregado para aplicar a pressão desejada.
ID:(11179, 0)
