Praktikum Absolute Temperatur
Storyboard 
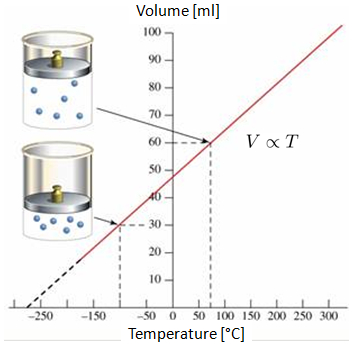
Mit Hilfe des Charles'schen Gesetzes kann die Temperatur des absoluten Nullpunkts geschätzt werden. Dazu wird bei 0 ° C ein Gasvolumen bei 100 ° C kontrahiert und nach dem Charles'schen Gesetz ist es sowohl mit Volumen als auch mit Temperaturen möglich, den absoluten Nullpunkt abzuschätzen.
ID:(1478, 0)
Praktikum Absolute Temperatur
Storyboard 
Mit Hilfe des Charles'schen Gesetzes kann die Temperatur des absoluten Nullpunkts geschätzt werden. Dazu wird bei 0 ° C ein Gasvolumen bei 100 ° C kontrahiert und nach dem Charles'schen Gesetz ist es sowohl mit Volumen als auch mit Temperaturen möglich, den absoluten Nullpunkt abzuschätzen.
Variablen
Berechnungen
Berechnungen
Gleichungen
Das Gesetz von Charles besagt, dass bei konstantem die Druck ($p$) das Verh ltnis von der Volumen ($V$) zu die Absolute Temperatur ($T$) gleich die Charles-Gesetz-Konstante ($C_c$) ist:
Dies bedeutet, dass wenn ein Gas von einem Anfangszustand (der Volumen im Zustand i ($V_i$) und die Temperatur im Ausgangszustand ($T_i$)) zu einem Endzustand (der Volumen im Zustand f ($V_f$) und die Temperatur im Endzustand ($T_f$)) bergeht und dabei die Druck ($p$) konstant gehalten wird, es immer dem Gesetz von Charles gehorchen muss:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Daher ergibt sich:
Beispiele
Wenn das Volumen eines Gases bei 0 C und 100 C gemessen wird, zeigt sich ein lineares Verhalten im Volumen-Temperatur-Diagramm. Wenn die Gerade fortgesetzt wird, zeigt sich, dass das Volumen bei bestimmten negativen Temperaturen (in Celsius oder Fahrenheit) den Wert Null erreicht. Dieser Punkt wird als absoluter Nullpunkt bezeichnet.
Es ist wichtig zu beachten, dass in der Realit t die Situation, in der das Volumen tats chlich null wird, nicht erreicht werden kann, da alle Gase sich lange vor dem absoluten Nullpunkt kondensieren und verfestigen.
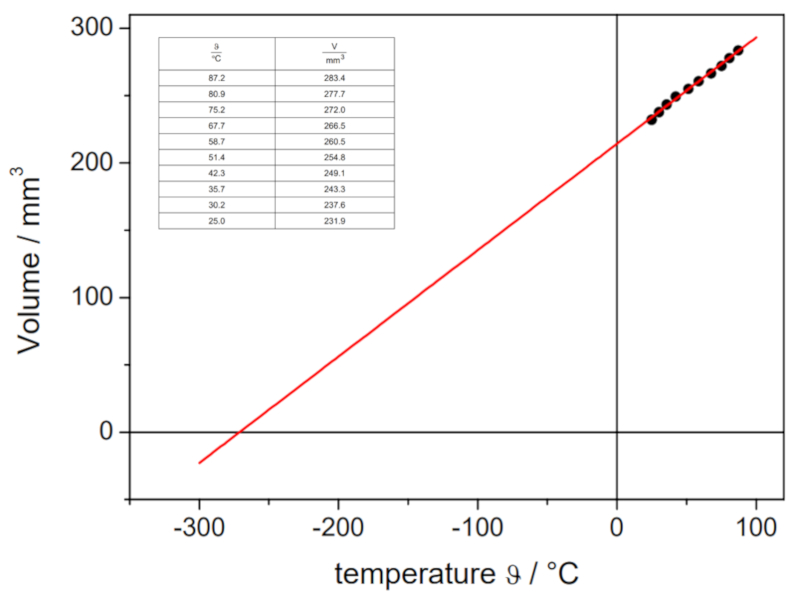
In dem folgenden Video wird gezeigt, wie im Labor die Volumina eines Gases bei unterschiedlichen Temperaturen bestimmt werden, um die Volumen-Temperatur-Kurve bei konstantem Druck zu erstellen. Durch den Schnittpunkt der Geraden mit der Temperaturachse kann die theoretische absolute Temperatur ermittelt werden, bei der das Volumen theoretisch null sein sollte:
Die erhaltenen Werte lauten:
| V [ml] | T [C] |
| 152.1 | 3.7 |
| 165.1 | 21.9 |
| 183.1 | 43.0 |
Diese werden grafisch dargestellt, einschlie lich der durch Regression berechneten Geraden:
Diese Sch tzung ergibt einen Wert von -148 C, der vom tats chlichen Wert von -273.15 C abweicht.
Das Gesetz von Charles legt eine Beziehung zwischen der Volumen ($V$) und die Absolute Temperatur ($T$) fest und besagt, dass ihr Verh ltnis gleich die Charles-Gesetz-Konstante ($C_c$) ist, wie folgt:
Das Gesetz von Charles legt eine Beziehung zwischen der Volumen ($V$) und die Absolute Temperatur ($T$) fest und besagt, dass ihr Verh ltnis gleich die Charles-Gesetz-Konstante ($C_c$) ist, wie folgt:
Wenn ein Gas von einem Anfangszustand (i) zu einem Endzustand (f) bergeht und die Druck ($p$) konstant gehalten wird, gilt f r der Volumen im Zustand i ($V_i$), der Volumen im Zustand f ($V_f$), die Temperatur im Ausgangszustand ($T_i$) und die Temperatur im Endzustand ($T_f$):
ID:(1478, 0)