Praktikum Gasgesetze
Storyboard 
In einem Gerät, in dem Druck, Volumen und Temperatur geändert werden können, werden verschiedene Anfangszustände definiert und es wird untersucht, wie sich diese ändern, indem jeweils zwei der Zustandsvariablen geändert werden.
ID:(1317, 0)
Boyles Gesetz Experiment
Bild 
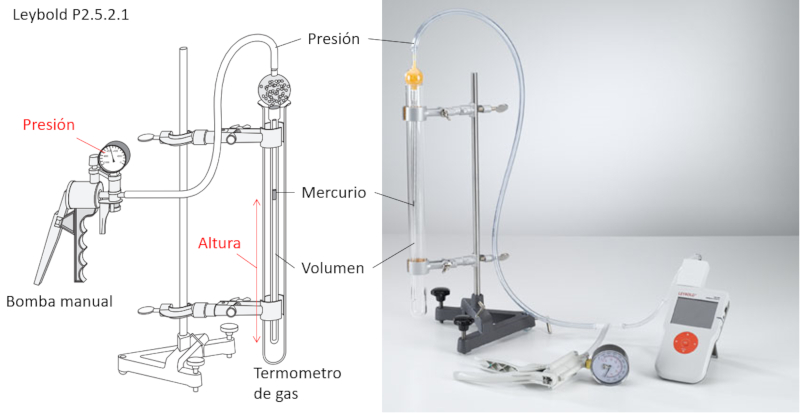
Um das Boyle'sche Gesetz zu studieren, werden folgende Elemente benötigt:
• Manuelle Luftpumpe
• Gasvolumen-gesteuertes Thermometer
Das gasvolumengesteuerte Thermometer ist ein Rohr, das ein weiteres Rohr enthält, das mit der Pumpe verbunden ist und ein kleines Volumen Quecksilber enthält.
Der externe Zylinder ermöglicht die Einstellung der Temperatur für das Experiment.
Wenn der Druck mit der Pumpe erhöht wird, bewegt sich das Quecksilber und komprimiert das eingeschlossene Volumen. Dadurch kann das zugehörige Volumen für jeden Druck gemessen werden, wobei sichergestellt wird, dass die Temperatur konstant bleibt.
Zusätzlich umschließt das Quecksilber das Volumen, um sicherzustellen, dass die Anzahl der Mole konstant bleibt.
ID:(11174, 0)
Boyles Gesetz Experiment, Data
Notiz 
Wenn das Experiment für eine definierte Temperatur und Anzahl von Gasmoles durchgeführt wird, können Daten beobachtet werden, wie sie unten aufgelistet und im folgenden Diagramm dargestellt sind:
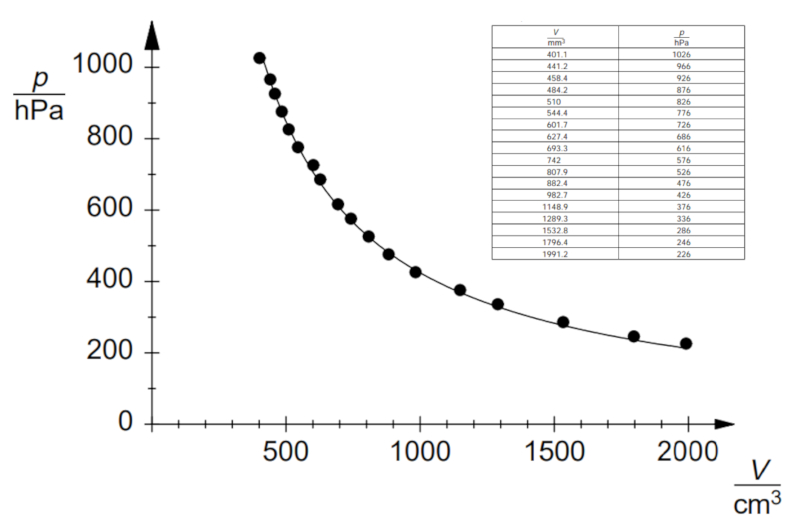
Dies zeigt das Boyle'sche Gesetz, das besagt, dass der Druck $p$ und das Volumen $V$ umgekehrt proportional zueinander variieren gemäß der folgenden Beziehung:
ID:(11177, 0)
Charles Gesetz Experiment
Zitat 
Um das Gesetz von Charles zu studieren, werden folgende Ausrüstungen benötigt:
• Ein Gas-Thermometer mit kontrolliertem Volumen.
• Eine Temperaturmesssonde.
In diesem Fall kann der innere Zylinder des Gas-Thermometers entweder offen gelassen werden, um Umgebungsdruck zu verwenden, oder mit einer Pumpe abgedichtet werden, um einen definierten Druck aufrechtzuerhalten.
Für die Messung wird die Temperatur im äußeren Zylinder des Gas-Thermometers variiert, und der Temperaturwert wird mit der Sonde gemessen.
Darüber hinaus wird beobachtet, wie sich das Volumen des Quecksilbers verändert, indem es sich entweder vergrößert oder verkleinert, was ebenfalls gemessen werden kann.
Zusätzlich umschließt das Quecksilber das Volumen und stellt sicher, dass die Anzahl der Mol konstant bleibt.

ID:(11175, 0)
Charles Gesetz Experiment, Data
Übung 
Wenn das Experiment mit einem definierten Druck und einer bestimmten Anzahl von Gasmoles durchgeführt wird, können Daten wie unten aufgelistet und im folgenden Diagramm dargestellt werden:
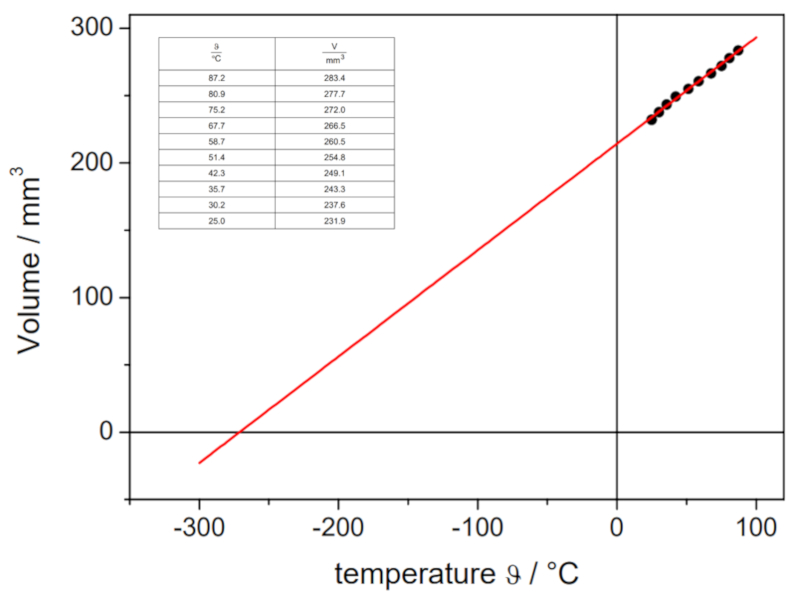
Dies illustriert das Gesetz von Charles, das besagt, dass die Temperatur $T$ und das Volumen $V$ proportional zueinander variieren gemäß folgender Beziehung:
ID:(11178, 0)
Gay Lussac Gesetz Experiment
Gleichung 
Um das Gesetz von Gay-Lussac zu untersuchen, werden folgende Ausrüstungen benötigt:
• Eine manuelle Luftpumpe
• Ein Gas-Thermometer mit kontrolliertem Volumen
• Eine Temperaturmesssonde
In diesem Fall arbeitet man mit einem vordefinierten Volumen.
Um die Messung durchzuführen, wird die Temperatur im äußeren Zylinder des Gas-Thermometers variiert und der Temperaturwert mit der Sonde gemessen.
Anschließend wird der Druck mithilfe einer Luftpumpe angepasst, bis das Volumen den vordefinierten Wert erreicht.
Das Experiment wird mit einer anderen Temperatur wiederholt, wobei der Druck erneut angepasst wird, um dasselbe Volumen zu erreichen.
Zusätzlich umschließt das Quecksilber das Volumen und stellt sicher, dass die Anzahl der Mol konstant bleibt.

ID:(11176, 0)
Gay Lussac Gesetz Experiment, Data
Script 
Wenn das Experiment mit einem definierten Volumen und einer bestimmten Anzahl von Gasmoles durchgeführt wird, können Daten wie unten aufgelistet und im folgenden Diagramm dargestellt werden:
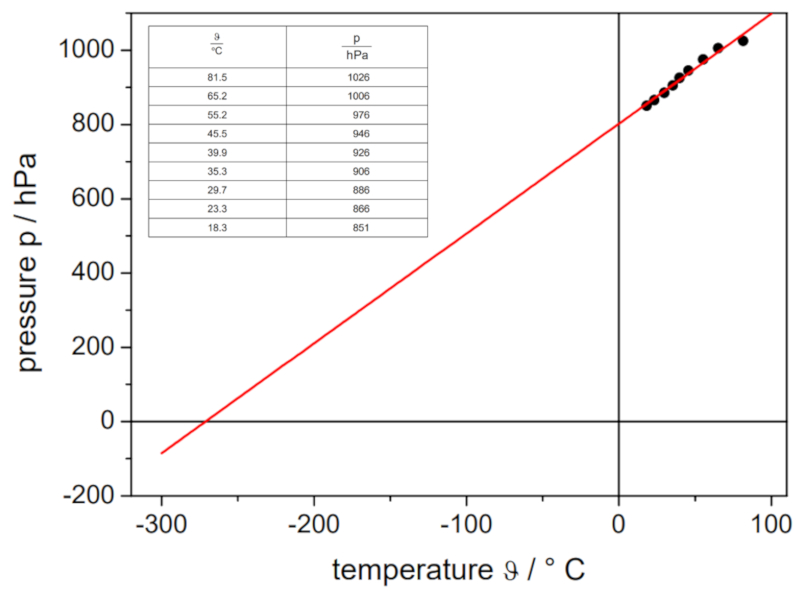
Dies illustriert das Gesetz von Gay-Lussac, das besagt, dass die Temperatur $T$ und der Druck $p$ gemäß folgender Beziehung proportional zueinander variieren:
ID:(11180, 0)
Handpumpe
Variable 
Um Gas zu pumpen, wird ein Instrument konstruiert, das aus einer Kammer und einem Kolben mit zwei Öffnungen besteht.
Jedes Mal, wenn der Kolben zurückgezogen wird (ansaugt), gelangt das Gas durch die offene Einlassöffnung in die Kompressionskammer, während der Auslass geschlossen bleibt.
Dann, wenn der Kolben bewegt wird, um Druck zu erzeugen, verschiebt er sich mit geschlossener Öffnung und komprimiert das Gas, bis der Druck den des Systems übersteigt, in das das Gas eingespritzt werden soll. Zu diesem Zeitpunkt öffnet sich die zweite Öffnung, sodass das komprimierte Gas entweichen kann und dazu beiträgt, den Druck des zu komprimierenden Systems weiter zu erhöhen.
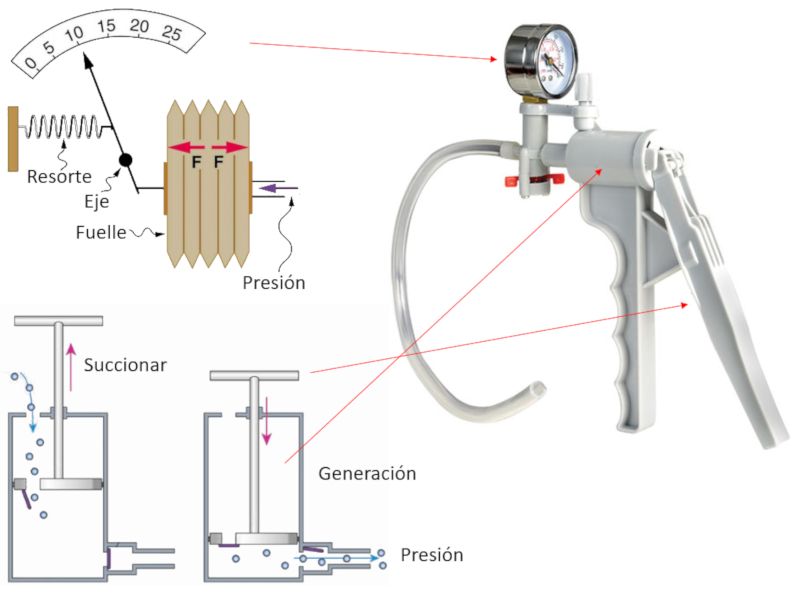
Der erreichte Druck wird mechanisch gemessen, indem eine Membran mit einer Nadel verbunden wird, die sich entsprechend der Verschiebung bewegt und den erreichten Druck anzeigt.
ID:(11181, 0)
Gasthermometer
Audio 
Der mit Gas gefüllte Kolben wird in die zu messende Flüssigkeit eingetaucht, wodurch das Gas sich mit der Temperatur ausdehnt oder zusammenzieht. Der Gasdruck wird mit der Quecksilbersäule ausgeglichen, und die Höhe kann entsprechend der Temperatur kalibriert werden:
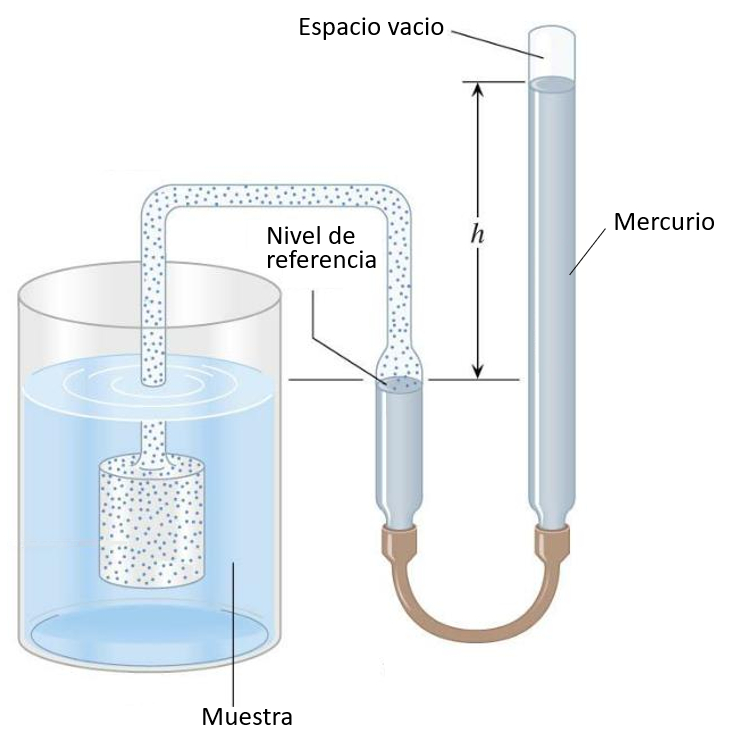
Bei Gasexperimenten wird eine Vakuumkammer verwendet, um das gewünschte Gas für das Experiment einzuschließen. Anstelle eines Gases zur Temperaturmessung wird dieses Gas verwendet, um den gewünschten Druck anzuwenden.
ID:(11179, 0)
