Avogadro-Prinzip
Storyboard 
Das Avogadro-Prinzip besagt, dass die Division von der Anzahl der Mol ($n$) durch der Volumen ($V$) konstant ist, während die Druck ($p$) und die Absolute Temperatur ($T$) konstant sind.
Das bedeutet, dass der Anzahl der Mol ($n$) proportional zu der Volumen ($V$) variiert.
ID:(1475, 0)
Avogadro-Prinzip
Storyboard 
Das Avogadro-Prinzip besagt, dass die Division von 9339 durch 5226 konstant ist, während 5224 und 5177 konstant sind. Das bedeutet, dass 9339 proportional zu 5226 variiert.
Variablen
Berechnungen
Berechnungen
Gleichungen
Das Avogadro-Prinzip besagt, dass wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, das Verh ltnis von ERROR:6679 zu der Volumen ($V$) gleich die Konstante des Avogadro-Prinzips ($C_a$) ist:
Das bedeutet, dass wenn ein Gas von einem Anfangszustand (der Anzahl der Maulwürfe im Staat i ($n_i$) und der Volumen im Zustand i ($V_i$)) zu einem Endzustand (der Anzahl der Maulwürfe im Staat f ($n_f$) und der Volumen im Zustand f ($V_f$)) bergeht, w hrend die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, das Gay-Lussac-Gesetz immer gilt:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Daher haben wir:
Beispiele
Das Avogadro-Prinzip besagt, dass gleiche Volumina von Gasen bei gleicher Temperatur und gleichem Druck die gleiche Anzahl von Molek len enthalten. Das bedeutet, dass das Volumen eines Gases direkt proportional zur Anzahl der vorhandenen Molek le (oder Mol) ist, wenn Temperatur und Druck konstant gehalten werden. Dieses Prinzip ist grundlegend f r das Verst ndnis des Verhaltens von Gasen und bildet die Grundlage des idealen Gasgesetzes. Es erm glicht die Bestimmung der Menge an Gas in einem gegebenen Volumen und ist wesentlich f r Berechnungen, die chemische Reaktionen und Gasgemische betreffen.
Es gibt intensive und extensive Variablen. Die ersten sind eigenst ndig f r den Zustand des Systems und h ngen nicht von seiner Gr e ab. Zwei Beispiele sind die Druck ($p$) und die Absolute Temperatur ($T$). Wenn wir ein gr eres System im gleichen Zustand w nschen, m ssen sowohl die Druck ($p$) als auch die Absolute Temperatur ($T$) gleich bleiben.
Die Situation ist anders bei der Volumen ($V$), das eine extensive Variable ist, das bedeutet, wenn ein gr eres System ben tigt wird, muss sie entsprechend zunehmen. Das Gleiche gilt f r der Gesamtzahl der Molen ($n$):
Zus tzlich m ssen beide im gleichen Verh ltnis zunehmen, also wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant sind, sind sie proportional zueinander:
$n \propto V$
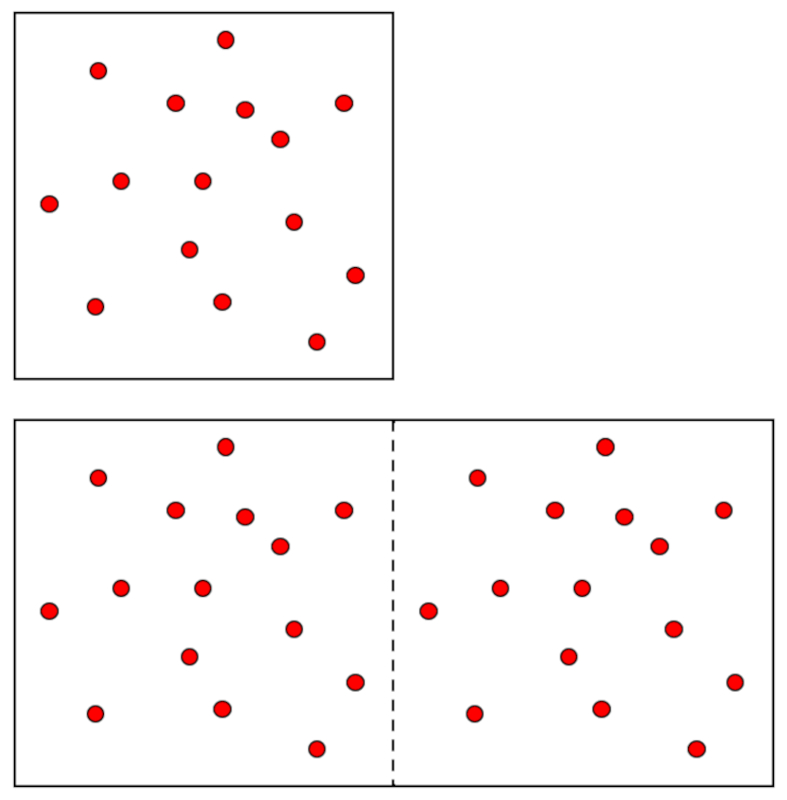
In einem Gas, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, wird eine proportionale Beziehung zwischen der Volumen ($V$) und der Anzahl der Mol ($n$) beobachtet. Jedes Mal, wenn der Volumen ($V$) zunimmt, wird festgestellt, dass auch der Anzahl der Mol ($n$) zunimmt, und umgekehrt,
$n \propto V$
wie im folgenden Diagramm dargestellt:
Das Avogadrosche Gesetz [1] besagt, dass der Volumen ($V$) und der Anzahl der Mol ($n$) direkt proportional sind, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden.
Diese Beziehung kann wie folgt ausgedr ckt werden, unter Verwendung von die Konstante des Avogadro-Prinzips ($C_a$):
![]() [1] "Versuch ber eine Methode, die relativen Massen der Elementarmolek le der K rper zu bestimmen und die Verh ltnisse, in denen sie sich in diesen Verbindungen befinden" (Essay ber eine Methode zur Bestimmung der relativen Massen der elementaren Molek le von K rpern und der Verh ltnisse, in denen sie sich in diesen Verbindungen befinden), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Versuch ber eine Methode, die relativen Massen der Elementarmolek le der K rper zu bestimmen und die Verh ltnisse, in denen sie sich in diesen Verbindungen befinden" (Essay ber eine Methode zur Bestimmung der relativen Massen der elementaren Molek le von K rpern und der Verh ltnisse, in denen sie sich in diesen Verbindungen befinden), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
Amadeo Avogadro, mit vollem Namen Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, war ein italienischer Wissenschaftler, der am 9. August 1776 geboren wurde und am 9. Juli 1856 verstarb. Avogadro ist vor allem f r seine Beitr ge zur Entwicklung der Molekularteorie und zur Formulierung des Avogadro-Gesetzes bekannt. Er schlug vor, dass gleiche Volumina von Gasen bei gleicher Temperatur und Druck eine gleiche Anzahl von Teilchen enthalten, was heute als Avogadrosches Gesetz bekannt ist. Dieses Konzept war grundlegend f r die Entwicklung des Stoffmengenkonzepts und legte die Grundlage f r das Verst ndnis der Beziehungen zwischen der Menge an Stoff, dem Volumen und der Anzahl der Teilchen in Gasen. Trotz seiner bedeutenden Beitr ge wurde Avogadros Arbeit zu Lebzeiten nicht weitgehend anerkannt, und seine Ideen fanden erst Jahre nach seinem Tod gr ere Zustimmung. Heutzutage wird Avogadro f r seine grundlegenden Beitr ge zur Chemie geehrt und gilt als einer der Pioniere der modernen Molekularteorie.
Das Avogadro-Prinzip besagt, dass wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, das Verh ltnis von ERROR:6679 zu der Volumen ($V$) gleich die Konstante des Avogadro-Prinzips ($C_a$) ist:
Das bedeutet, dass wenn ein Gas von einem Anfangszustand (der Anzahl der Maulwürfe im Staat i ($n_i$) und der Volumen im Zustand i ($V_i$)) zu einem Endzustand (der Anzahl der Maulwürfe im Staat f ($n_f$) und der Volumen im Zustand f ($V_f$)) bergeht, w hrend die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, das Gay-Lussac-Gesetz immer gilt:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Daher haben wir:
Das Avogadrosche Gesetz besagt, dass der Volumen ($V$) und der Anzahl der Mol ($n$) direkt proportional sind, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden.
Diese Beziehung kann wie folgt ausgedr ckt werden, unter Verwendung von die Konstante des Avogadro-Prinzips ($C_a$):
Das Avogadrosche Gesetz besagt, dass der Volumen ($V$) und der Anzahl der Mol ($n$) direkt proportional sind, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden.
Diese Beziehung kann wie folgt ausgedr ckt werden, unter Verwendung von die Konstante des Avogadro-Prinzips ($C_a$):
Wenn ein Gas von einem Anfangszustand (i) zu einem Endzustand (f) bergeht und dabei die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, gilt f r der Anzahl der Maulwürfe im Staat i ($n_i$), der Volumen im Zustand i ($V_i$), der Anzahl der Maulwürfe im Staat f ($n_f$) und der Volumen im Zustand f ($V_f$) :
ID:(1475, 0)