Mécanismes
Concept 
Le cycle d'Otto comprend quatre étapes principales : l'admission, la compression, la détente (ou combustion) et l'échappement. Lors de la phase d'admission, le moteur aspire un mélange de carburant et d'air tandis que le piston descend. Ce mélange est ensuite comprimé lorsque le piston remonte, ce qui augmente la température et la pression du gaz. Au sommet du mouvement de compression, la bougie d'allumage enflamme le mélange comprimé, provoquant une combustion rapide connue sous le nom de temps moteur. Cette combustion pousse le piston vers le bas, fournissant de l'énergie au moteur.
Après le temps moteur, la soupape d'échappement s'ouvre et le piston remonte pour expulser les gaz brûlés de la combustion hors du cylindre, complétant ainsi le cycle. Le moteur répète ensuite ce cycle en continu pendant son fonctionnement.
L'efficacité d'un moteur fonctionnant selon le cycle d'Otto dépend du degré de compression et des propriétés du carburant utilisé. Des taux de compression plus élevés conduisent généralement à une meilleure efficacité, mais nécessitent un carburant à plus haut indice d'octane pour prévenir le cliquetis du moteur. Le cycle d'Otto se caractérise par sa rapidité avec chaque étape clairement définie, contribuant de manière significative à l'efficience globale et à la puissance délivrée par les moteurs qui l'utilisent.
ID:(15282, 0)
Cycle de Carnot
Concept 
Sadi Carnot a introduit [1] le concept théorique du premier projet de machine capable de générer du travail mécanique basé sur un gradient de température. Cela est réalisé grâce à un processus dans l'espace pression-volume où la chaleur est ajoutée et extraite, comme illustré dans l'image :
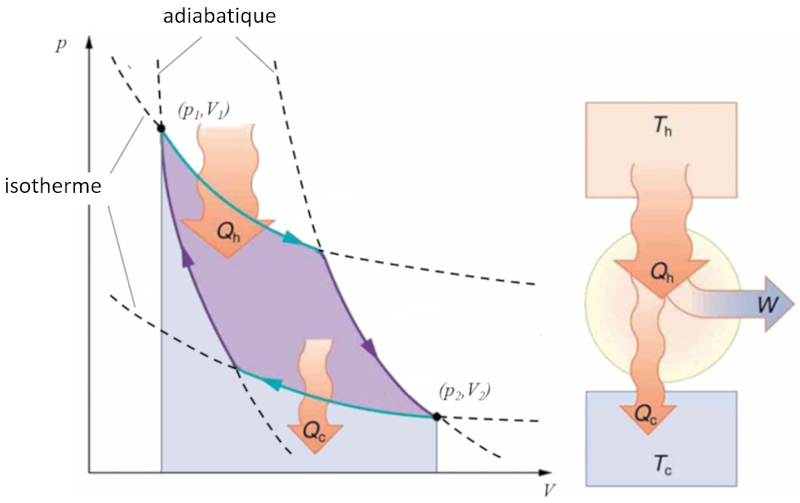
La zone sous la courbe le chaleur fournie ($Q_H$), s'étendant de 1 à 2, représente l'énergie nécessaire pour passer de l'état ($p_1, V_1$) à l'état ($p_2, V_2$). En revanche, la zone sous la courbe le chaleur absorbée ($Q_C$), allant de 2 à 1, représente l'extraction d'énergie nécessaire pour revenir de l'état ($p_2, V_2$) à l'état ($p_1, V_1$). La différence entre ces zones correspond à la région délimitée par les deux courbes et représente le travail efficace ($W$) que le système peut accomplir.
Carnot a également démontré que, conformément au deuxième principe de la thermodynamique, le chaleur fournie ($Q_H$) ne peut pas être nul. Cela implique qu'il n'existe pas de machines capables de convertir toute la chaleur en travail.![]() [1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance", Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
[1] "Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance", Sadi Carnot, Annales scientifiques de lÉ.N.S. 2e série, tome 1, p. 393-457 (1872)
ID:(11131, 0)
Cycle d'Otto : diagramme pression-volume
Concept 
Le cycle d'Otto [1] peut être considéré comme une solution technique basée sur le cycle de Carnot. Dans ce contexte, il se compose de quatre étapes qui se déroulent comme suit :
• Étape 1 à 2 : Compression adiabatique $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_2)$,
• Étape 2 à 3 : Chauffage $(p_2,V_2,T_2)\rightarrow(p_3,V_2,T_3)$,
• Étape 3 à 4 : Expansion adiabatique $(p_3,V_2,T_3)\rightarrow(p_4,V_1,T_4)$,
• Étape 4 à 1 : Refroidissement $(p_4,V_1,T_4)\rightarrow(p_1,V_1,T_1)$
Ces étapes sont illustrées dans le diagramme suivant :
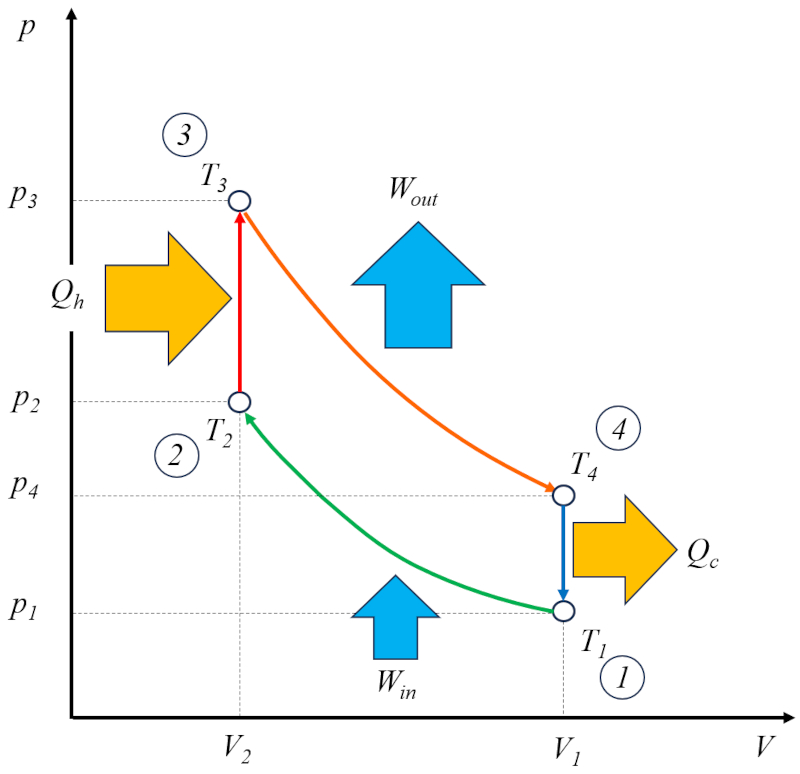
Sur le diagramme, le flux d'énergie est illustré, où Le chaleur fournie ($Q_H$) ajoute de l'énergie, faisant monter la température de a température à l'état 2 ($T_2$) à A température à l'état 3 ($T_3$). Il entre dans le système et effectue un travail efficace ($W$) unités de travail, tandis que le complément le chaleur absorbée ($Q_C$) est absorbé, abaissant la température de a température à l'état 4 ($T_4$) à A température à l'état 1 ($T_1$).![]() [1] "Verbrennungsmotor" (Moteur à combustion interne), N. A. Otto, Kaiserlichen Patentamts, Brevet 532, 2 janvier 1877.Note : En 1862, Nikolaus Otto a tenté de construire le moteur à combustion interne breveté par Alphonse Beau de Rochas sans succès. Plus tard, il l'a modifié et a réussi à en construire un fonctionnel en 1877, fabriquant 30 000 moteurs silencieux et très fiables. Il a breveté son concept en 1877 ; cependant, le brevet a été révoqué ultérieurement en raison de l'existence du brevet d'Alphonse Beau de Rochas, même si Rochas n'a jamais réussi à construire sa version. Comme Otto a été le premier à faire fonctionner le moteur, sa version est aujourd'hui rappelée, désignant le processus comme le "Cycle d'Otto".
[1] "Verbrennungsmotor" (Moteur à combustion interne), N. A. Otto, Kaiserlichen Patentamts, Brevet 532, 2 janvier 1877.Note : En 1862, Nikolaus Otto a tenté de construire le moteur à combustion interne breveté par Alphonse Beau de Rochas sans succès. Plus tard, il l'a modifié et a réussi à en construire un fonctionnel en 1877, fabriquant 30 000 moteurs silencieux et très fiables. Il a breveté son concept en 1877 ; cependant, le brevet a été révoqué ultérieurement en raison de l'existence du brevet d'Alphonse Beau de Rochas, même si Rochas n'a jamais réussi à construire sa version. Comme Otto a été le premier à faire fonctionner le moteur, sa version est aujourd'hui rappelée, désignant le processus comme le "Cycle d'Otto".
ID:(11140, 0)
Éléments d'un réfrigérateur
Concept 
Le moteur Otto fonctionne selon deux cycles : le cycle Otto proprement dit, qui comprend les phases suivantes :
• Phase 1 à 2 : Compression adiabatique
• Phase 2 à 3 : Chauffage
• Phase 3 à 4 : Expansion adiabatique
• Phase 4 à 1 : Refroidissement
De plus, il possède un cycle pour vider les gaz brûlés et les remplir d'un nouveau mélange.
Pour cette raison, il est appelé un moteur deux temps. La phase de vidange et de remplissage peut être réalisée à l'aide d'une masse de compensation ou par le biais d'un second cylindre qui fonctionne en déphasage.
L'efficacité A efficacité ($\eta$) du moteur peut être estimée en utilisant le facteur de compressibilité Otto ($r$) et le indice adiabatique ($\kappa$) avec l'équation suivante :
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
ID:(11142, 0)
Efficacité en fonction des températures
Concept 
Le chaleur absorbée ($Q_C$) est lié à A capacité thermique à volume constant ($C_V$), a température à l'état 4 ($T_4$) et a température à l'état 1 ($T_1$) selon l'équation suivante :
| $ Q_C = C_V ( T_4 - T_1 )$ |
Et le chaleur fournie ($Q_H$) est lié à A capacité thermique à volume constant ($C_V$), a température à l'état 3 ($T_3$) et a température à l'état 2 ($T_2$) grâce à l'équation suivante :
| $ Q_H = C_V ( T_3 - T_2 )$ |
Par conséquent, dans l'équation pour a efficacité ($\eta$) représentée par :
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Nous avons la relation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
ID:(15749, 0)
Efficacité en fonction du facteur de compressibilité
Concept 
A efficacité ($\eta$), en fonction de a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$), est calculé à l'aide de l'équation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
Dans le cas de l'expansion adiabatique, elle est décrite à l'aide de le indice adiabatique ($\kappa$), le volume étendu ($V_1$) et le volume compressé ($V_2$) avec la relation suivante :
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
Et la compression adiabatique est représentée par la relation suivante :
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Si nous soustrayons la deuxième équation de la première, nous obtenons :
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
Ce qui nous conduit à la relation :
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Cela nous conduit à la définition de le facteur de compressibilité Otto ($r$) avec l'équation suivante :
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Avec tous ces composants, l'efficacité d'un processus utilisant le cycle Otto peut être calculée comme suit :
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
ID:(15750, 0)
Le Cycle Diesel
Modèle 
Variables
Calculs
Calculs
Équations
En suivant une analogie avec le ERROR:5219,0 pour les liquides et les solides avec a capacité calorique ($C$) et a masse ($M$) :
| $ c =\displaystyle\frac{ C }{ M }$ |
il existe galement un chaleur spécifique des gaz à volume constant ($c_V$) pour le chauffage volume constant avec a capacité thermique à volume constant ($C_V$) :
| $ c_V =\displaystyle\frac{ C_V }{ M }$ |
(ID 11113)
Lors du retrait de le chaleur absorbée ($Q_C$), la temp rature du gaz augmente de $T_1$ $T_4$ dans un processus isobare ( pression constante). Cela implique que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, qui est exprim e par l' quation :
| $ dU = C_V \Delta T $ |
Cela nous am ne aux valeurs de a température à l'état 1 ($T_1$) et a température à l'état 4 ($T_4$) en utilisant la formule :
| $ Q_C = C_V ( T_4 - T_1 )$ |
(ID 11145)
En fournissant le chaleur fournie ($Q_H$), la temp rature du gaz augmente de $T_2$ $T_3$ dans un processus isochore ( volume constant). Cela signifie que nous pouvons utiliser la relation pour ERROR:8085 avec a capacité thermique à volume constant ($C_V$) et ERROR:7510, exprim e par l' quation suivante :
| $ dU = C_V \Delta T $ |
Cela donne les valeurs de a température à l'état 2 ($T_2$) et a température à l'état 3 ($T_3$) comme suit :
| $ Q_H = C_V ( T_3 - T_2 )$ |
(ID 11157)
Lors d'une expansion adiabatique, le gaz respecte la relation impliquant le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$) et a température à l'état final ($T_f$) :
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Dans ce cas, du point initial 3 au point 4. Cela signifie que pendant l'expansion adiabatique, l' tat du gaz change de le volume compressé ($V_2$) et a température à l'état 3 ($T_3$) Le volume étendu ($V_1$) et a température à l'état 4 ($T_4$) selon :
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
(ID 11159)
tant donn qu'en expansion adiabatique, le gaz satisfait la relation avec le volume à l'état i ($V_i$), le volume à l'état f ($V_f$), a température à l'état initial ($T_i$) et a température à l'état final ($T_f$) :
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Dans ce cas, du point initial 1 au point 2. Cela signifie que pendant la compression adiabatique, l' tat du gaz passe de le volume étendu ($V_1$) et a température à l'état 1 ($T_1$) Le volume compressé ($V_2$) et a température à l'état 2 ($T_2$) comme suit :
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
(ID 11160)
Le chaleur absorbée ($Q_C$) est li a capacité thermique à volume constant ($C_V$), a température à l'état 4 ($T_4$) et a température à l'état 1 ($T_1$) selon l' quation suivante :
| $ Q_C = C_V ( T_4 - T_1 )$ |
Et le chaleur fournie ($Q_H$) est li a capacité thermique à volume constant ($C_V$), a température à l'état 3 ($T_3$) et a température à l'état 2 ($T_2$) gr ce l' quation suivante :
| $ Q_H = C_V ( T_3 - T_2 )$ |
Par cons quent, dans l' quation pour a efficacité ($\eta$) repr sent e par :
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Nous avons la relation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 11161)
L'expansion adiabatique est d crite l'aide des variables le indice adiabatique ($\kappa$), a température à l'état 4 ($T_4$), a température à l'état 3 ($T_3$), le volume étendu ($V_1$) et le volume compressé ($V_2$) travers la relation
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
Tandis que la compression adiabatique est repr sent e par a température à l'état 1 ($T_1$) et a température à l'état 2 ($T_2$) travers la relation
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
En soustrayant la deuxi me quation de la premi re, nous obtenons
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
Ce qui nous conduit la relation
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Et cela nous permet de d finir le facteur de compressibilité Otto ($r$) de la mani re suivante :
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
(ID 11162)
A efficacité ($\eta$), en fonction de a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$), est calcul l'aide de l' quation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
Dans le cas de l'expansion adiabatique, elle est d crite l'aide de le indice adiabatique ($\kappa$), le volume étendu ($V_1$) et le volume compressé ($V_2$) avec la relation suivante :
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
Et la compression adiabatique est repr sent e par la relation suivante :
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Si nous soustrayons la deuxi me quation de la premi re, nous obtenons :
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
Ce qui nous conduit la relation :
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Cela nous conduit la d finition de le facteur de compressibilité Otto ($r$) avec l' quation suivante :
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Avec tous ces composants, l'efficacit d'un processus utilisant le cycle Otto peut tre calcul e comme suit :
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
.
(ID 11163)
Exemples
Le cycle d'Otto comprend quatre tapes principales : l'admission, la compression, la d tente (ou combustion) et l' chappement. Lors de la phase d'admission, le moteur aspire un m lange de carburant et d'air tandis que le piston descend. Ce m lange est ensuite comprim lorsque le piston remonte, ce qui augmente la temp rature et la pression du gaz. Au sommet du mouvement de compression, la bougie d'allumage enflamme le m lange comprim , provoquant une combustion rapide connue sous le nom de temps moteur. Cette combustion pousse le piston vers le bas, fournissant de l' nergie au moteur.
Apr s le temps moteur, la soupape d' chappement s'ouvre et le piston remonte pour expulser les gaz br l s de la combustion hors du cylindre, compl tant ainsi le cycle. Le moteur r p te ensuite ce cycle en continu pendant son fonctionnement.
L'efficacit d'un moteur fonctionnant selon le cycle d'Otto d pend du degr de compression et des propri t s du carburant utilis . Des taux de compression plus lev s conduisent g n ralement une meilleure efficacit , mais n cessitent un carburant plus haut indice d'octane pour pr venir le cliquetis du moteur. Le cycle d'Otto se caract rise par sa rapidit avec chaque tape clairement d finie, contribuant de mani re significative l'efficience globale et la puissance d livr e par les moteurs qui l'utilisent.
(ID 15282)
Sadi Carnot a introduit [1] le concept th orique du premier projet de machine capable de g n rer du travail m canique bas sur un gradient de temp rature. Cela est r alis gr ce un processus dans l'espace pression-volume o la chaleur est ajout e et extraite, comme illustr dans l'image :

La zone sous la courbe le chaleur fournie ($Q_H$), s' tendant de 1 2, repr sente l' nergie n cessaire pour passer de l' tat ($p_1, V_1$) l' tat ($p_2, V_2$). En revanche, la zone sous la courbe le chaleur absorbée ($Q_C$), allant de 2 1, repr sente l'extraction d' nergie n cessaire pour revenir de l' tat ($p_2, V_2$) l' tat ($p_1, V_1$). La diff rence entre ces zones correspond la r gion d limit e par les deux courbes et repr sente le travail efficace ($W$) que le syst me peut accomplir.
Carnot a galement d montr que, conform ment au deuxi me principe de la thermodynamique, le chaleur fournie ($Q_H$) ne peut pas tre nul. Cela implique qu'il n'existe pas de machines capables de convertir toute la chaleur en travail.![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance", Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
(ID 11131)
Le cycle d'Otto [1] peut tre consid r comme une solution technique bas e sur le cycle de Carnot. Dans ce contexte, il se compose de quatre tapes qui se d roulent comme suit :
• tape 1 2 : Compression adiabatique $(p_1,V_1,T_1)\rightarrow(p_2,V_2,T_2)$,
• tape 2 3 : Chauffage $(p_2,V_2,T_2)\rightarrow(p_3,V_2,T_3)$,
• tape 3 4 : Expansion adiabatique $(p_3,V_2,T_3)\rightarrow(p_4,V_1,T_4)$,
• tape 4 1 : Refroidissement $(p_4,V_1,T_4)\rightarrow(p_1,V_1,T_1)$
Ces tapes sont illustr es dans le diagramme suivant :

Sur le diagramme, le flux d' nergie est illustr , o le chaleur fournie ($Q_H$) ajoute de l' nergie, faisant monter la temp rature de a température à l'état 2 ($T_2$) A température à l'état 3 ($T_3$). Il entre dans le syst me et effectue un travail efficace ($W$) unit s de travail, tandis que le compl ment le chaleur absorbée ($Q_C$) est absorb , abaissant la temp rature de a température à l'état 4 ($T_4$) A température à l'état 1 ($T_1$).![]() [1] "Verbrennungsmotor" (Moteur combustion interne), N. A. Otto, Kaiserlichen Patentamts, Brevet 532, 2 janvier 1877.Note : En 1862, Nikolaus Otto a tent de construire le moteur combustion interne brevet par Alphonse Beau de Rochas sans succ s. Plus tard, il l'a modifi et a r ussi en construire un fonctionnel en 1877, fabriquant 30 000 moteurs silencieux et tr s fiables. Il a brevet son concept en 1877 ; cependant, le brevet a t r voqu ult rieurement en raison de l'existence du brevet d'Alphonse Beau de Rochas, m me si Rochas n'a jamais r ussi construire sa version. Comme Otto a t le premier faire fonctionner le moteur, sa version est aujourd'hui rappel e, d signant le processus comme le "Cycle d'Otto".
[1] "Verbrennungsmotor" (Moteur combustion interne), N. A. Otto, Kaiserlichen Patentamts, Brevet 532, 2 janvier 1877.Note : En 1862, Nikolaus Otto a tent de construire le moteur combustion interne brevet par Alphonse Beau de Rochas sans succ s. Plus tard, il l'a modifi et a r ussi en construire un fonctionnel en 1877, fabriquant 30 000 moteurs silencieux et tr s fiables. Il a brevet son concept en 1877 ; cependant, le brevet a t r voqu ult rieurement en raison de l'existence du brevet d'Alphonse Beau de Rochas, m me si Rochas n'a jamais r ussi construire sa version. Comme Otto a t le premier faire fonctionner le moteur, sa version est aujourd'hui rappel e, d signant le processus comme le "Cycle d'Otto".
(ID 11140)
Le moteur Otto fonctionne selon deux cycles : le cycle Otto proprement dit, qui comprend les phases suivantes :
• Phase 1 2 : Compression adiabatique
• Phase 2 3 : Chauffage
• Phase 3 4 : Expansion adiabatique
• Phase 4 1 : Refroidissement
De plus, il poss de un cycle pour vider les gaz br l s et les remplir d'un nouveau m lange.

Pour cette raison, il est appel un moteur deux temps. La phase de vidange et de remplissage peut tre r alis e l'aide d'une masse de compensation ou par le biais d'un second cylindre qui fonctionne en d phasage.
L'efficacit a efficacité ($\eta$) du moteur peut tre estim e en utilisant le facteur de compressibilité Otto ($r$) et le indice adiabatique ($\kappa$) avec l' quation suivante :
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
(ID 11142)
Le chaleur absorbée ($Q_C$) est li a capacité thermique à volume constant ($C_V$), a température à l'état 4 ($T_4$) et a température à l'état 1 ($T_1$) selon l' quation suivante :
| $ Q_C = C_V ( T_4 - T_1 )$ |
Et le chaleur fournie ($Q_H$) est li a capacité thermique à volume constant ($C_V$), a température à l'état 3 ($T_3$) et a température à l'état 2 ($T_2$) gr ce l' quation suivante :
| $ Q_H = C_V ( T_3 - T_2 )$ |
Par cons quent, dans l' quation pour a efficacité ($\eta$) repr sent e par :
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
Nous avons la relation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 15749)
A efficacité ($\eta$), en fonction de a température à l'état 1 ($T_1$), a température à l'état 2 ($T_2$), a température à l'état 3 ($T_3$) et a température à l'état 4 ($T_4$), est calcul l'aide de l' quation suivante :
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
Dans le cas de l'expansion adiabatique, elle est d crite l'aide de le indice adiabatique ($\kappa$), le volume étendu ($V_1$) et le volume compressé ($V_2$) avec la relation suivante :
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
Et la compression adiabatique est repr sent e par la relation suivante :
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
Si nous soustrayons la deuxi me quation de la premi re, nous obtenons :
$(T_4 - T_1)V_1^{\kappa-1} = (T_3 - T_2)V_2^{\kappa-1}$
Ce qui nous conduit la relation :
$\left(\displaystyle\frac{V_1}{V_2}\right)^{\kappa-1} = \displaystyle\frac{T_3 - T_2}{T_4 - T_1}$
Cela nous conduit la d finition de le facteur de compressibilité Otto ($r$) avec l' quation suivante :
| $ r =\displaystyle\frac{ V_1 }{ V_2 }$ |
Avec tous ces composants, l'efficacit d'un processus utilisant le cycle Otto peut tre calcul e comme suit :
| $ \eta = 1-\displaystyle\frac{1}{ r ^{ \kappa -1}}$ |
(ID 15750)
(ID 15341)
ID:(1486, 0)
