Expérience de la loi de Boyle
Image 
Pour étudier la loi de Boyle, les éléments suivants sont nécessaires :
• Une pompe à air manuelle
• Un thermomètre à gaz à volume contrôlé
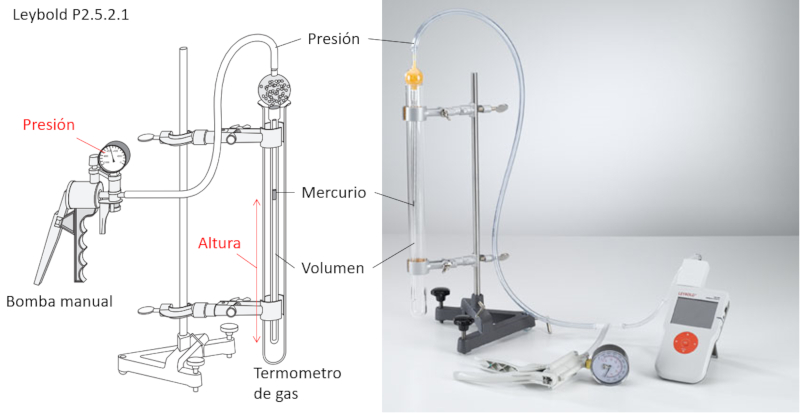
Le thermomètre à gaz à volume contrôlé est un tube qui contient à l'intérieur un autre tube relié à la pompe et contenant un petit volume de mercure.
À l'aide du cylindre externe, il est possible de fixer la température à laquelle l'expérience sera réalisée.
Lorsque la pression est augmentée à l'aide de la pompe, le mercure se déplace et comprime le volume qu'il contient. Cela permet de mesurer, pour chaque pression, le volume associé, en veillant à ce que la température reste constante.
De plus, le mercure encapsule le volume, garantissant ainsi que le nombre de moles reste constant.
ID:(11174, 0)
Expérience de la loi de Boyle
Noter 
Si l'expérience est réalisée avec une température et un nombre de moles de gaz définis, on peut observer des données telles que celles énumérées et représentées dans le graphique suivant:
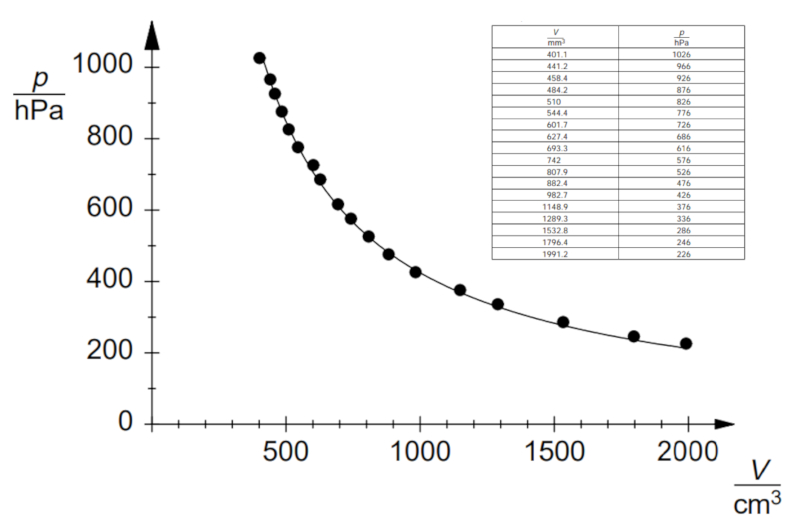
Cela démontre la loi de Boyle, qui établit que la pression $p$ et le volume $V$ varient de manière inverse selon la relation suivante :
ID:(11177, 0)
Expérience de la loi de Charles
Citation 
Pour étudier la loi de Charles, les équipements suivants sont nécessaires:
• Un thermomètre à gaz à volume contrôlé.
• Une sonde de mesure de température.
Dans ce cas, le cylindre interne du thermomètre à gaz peut être laissé ouvert, si l'on utilise la pression ambiante, ou être scellé avec une pompe pour maintenir une pression définie.
Pour effectuer la mesure, la température est variée dans le cylindre externe du thermomètre à gaz et la valeur de la température est mesurée à l'aide de la sonde.
De plus, on observe comment le volume du mercure se déplace, augmentant ou diminuant, ce qui peut également être mesuré.
De manière complémentaire, le mercure encapsule le volume, assurant ainsi que le nombre de moles reste constant.

ID:(11175, 0)
Expérience de la loi de Charles, données
Exercer 
Si l'expérience est réalisée avec une pression et un nombre de moles de gaz définis, on peut obtenir des données qui sont énumérées et représentées dans le graphique suivant :
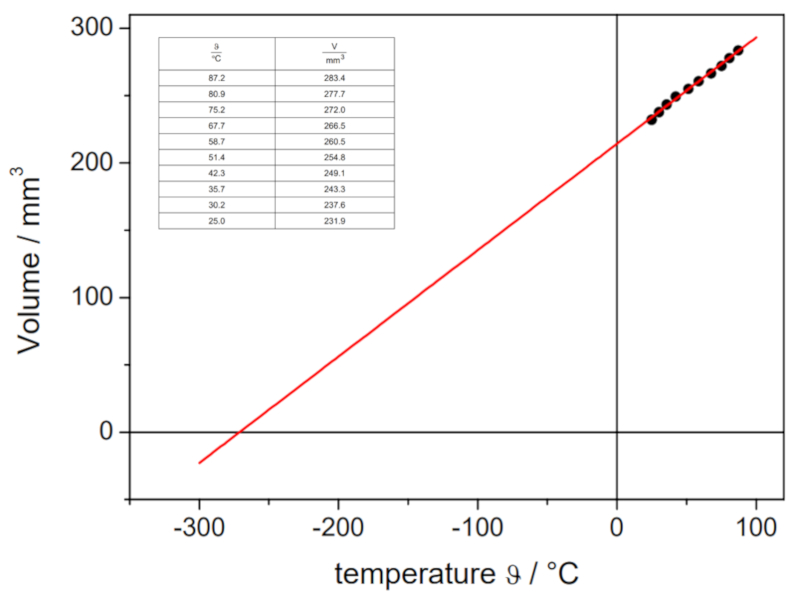
Cela illustre la loi de Charles, qui établit que la température $T$ et le volume $V$ varient de manière proportionnelle selon la relation suivante :
ID:(11178, 0)
Expérience de la loi de Gay Lussac
Équation 
Pour étudier la loi de Gay-Lussac, les équipements suivants sont nécessaires :
• Une pompe à air manuelle.
• Un thermomètre à gaz avec volume contrôlé.
• Une sonde de mesure de température.
Dans ce cas, on travaille avec un volume prédéfini.
Pour effectuer la mesure, on fait varier la température dans le cylindre externe du thermomètre à gaz et on mesure la valeur de la température avec la sonde.
Ensuite, on ajuste la pression à l'aide d'une pompe jusqu'à ce que le volume atteigne la valeur prédéfinie.
L'expérience est répétée avec une autre température, en ajustant à nouveau la pression pour obtenir le même volume.
De plus, le mercure encapsule le volume, assurant ainsi que le nombre de moles reste constant.

ID:(11176, 0)
Expérience sur la loi de Gay Lussac, données
Script 
Si l'expérience est réalisée avec un volume et un nombre de moles de gaz définis, on peut obtenir des données qui sont énumérées et représentées dans le graphique suivant :
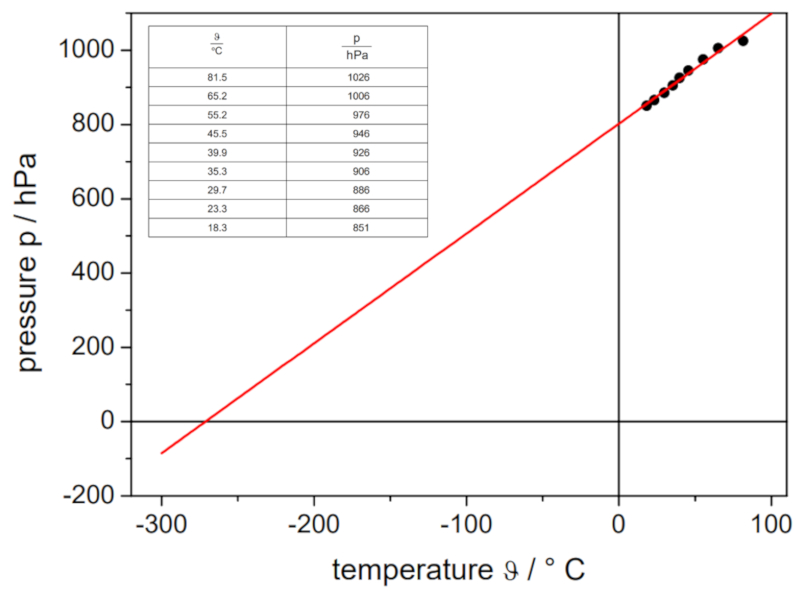
Cela illustre la loi de Gay-Lussac, qui établit que la température $T$ et la pression $p$ varient de manière proportionnelle selon la relation suivante :
ID:(11180, 0)
Pompe manuelle
Variable 
Pour pomper du gaz, on construit un instrument qui comprend une chambre et un piston avec deux ouvertures.
À chaque fois que le piston est retiré (aspiration), le gaz pénètre dans la chambre de compression par l'ouverture qui est ouverte, tandis que celle de sortie est fermée.
Ensuite, lorsqu'on déplace le piston pour générer de la pression, il se déplace avec l'ouverture fermée, comprimant le gaz jusqu'à ce que sa pression dépasse celle du système dans lequel on souhaite injecter le gaz. À ce moment-là, la deuxième ouverture s'ouvre, permettant au gaz comprimé de s'échapper et contribuant ainsi à augmenter la pression du système à comprimer.
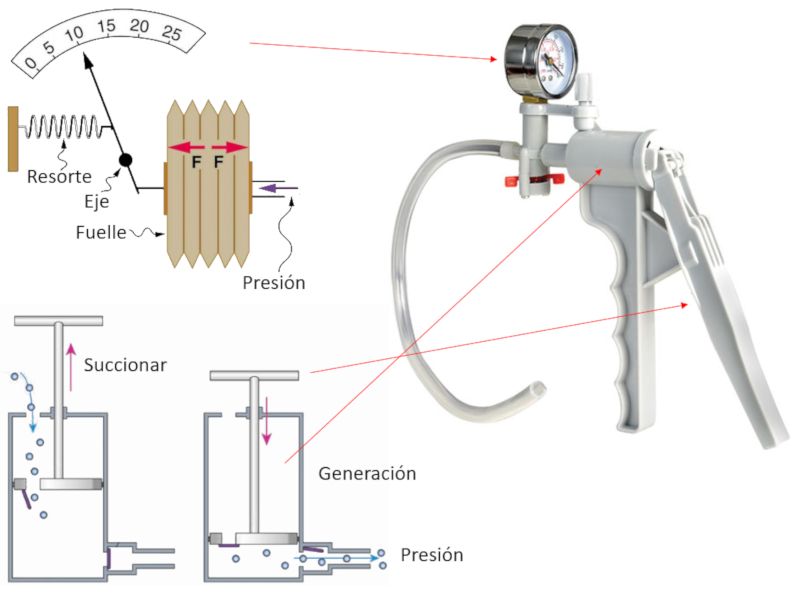
La pression obtenue est mesurée mécaniquement car il y a une membrane reliée à une aiguille qui se déplace en fonction de ce déplacement, indiquant ainsi la pression obtenue.
ID:(11181, 0)
Thermomètre à gaz
Audio 
Le piston rempli de gaz est plongé dans le liquide à mesurer, ce qui fait que le gaz se dilate ou se contracte en fonction de la température. La pression du gaz est compensée par la colonne de mercure, et la hauteur peut être calibrée en fonction de la température :
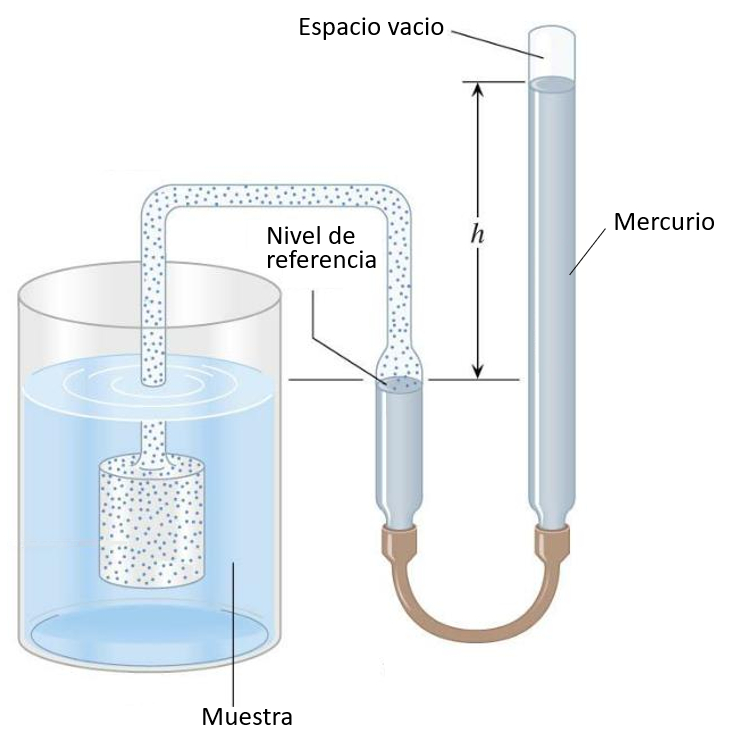
Dans le cas des expériences avec les gaz, une cavité sous vide est utilisée pour enfermer le gaz avec lequel on souhaite réaliser l'expérience. Au lieu d'utiliser un gaz pour mesurer la température, il est utilisé pour appliquer la pression souhaitée.
ID:(11179, 0)
