Le principe d'Avogadro
Storyboard 
Le principe d'Avogadro stipule que la division de le nombre de taupes ($n$) par le volume ($V$) est constante tandis que a pression ($p$) et a température absolue ($T$) sont constants.
Cela signifie que le nombre de taupes ($n$) varie proportionnellement à Le volume ($V$).
ID:(1475, 0)
Le principe d'Avogadro
Storyboard 
Le principe d'Avogadro stipule que la division de 9339 par 5226 est constante tandis que 5224 et 5177 sont constants. Cela signifie que 9339 varie proportionnellement à 5226.
Variables
Calculs
Calculs
Équations
Le principe d'Avogadro tablit que lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants, le rapport de ERROR:6679 Le volume ($V$) est gal a constante du principe d'Avogadro ($C_a$) :
Cela signifie que si un gaz passe d'un tat initial (le nombre de taupes dans l'état i ($n_i$) et le volume à l'état i ($V_i$)) un tat final (le nombre de taupes dans l'état f ($n_f$) et le volume à l'état f ($V_f$)) tout en maintenant a pression ($p$) et a température absolue ($T$) constants, la loi de Gay-Lussac doit toujours tre respect e :
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Par cons quent, nous avons :
Exemples
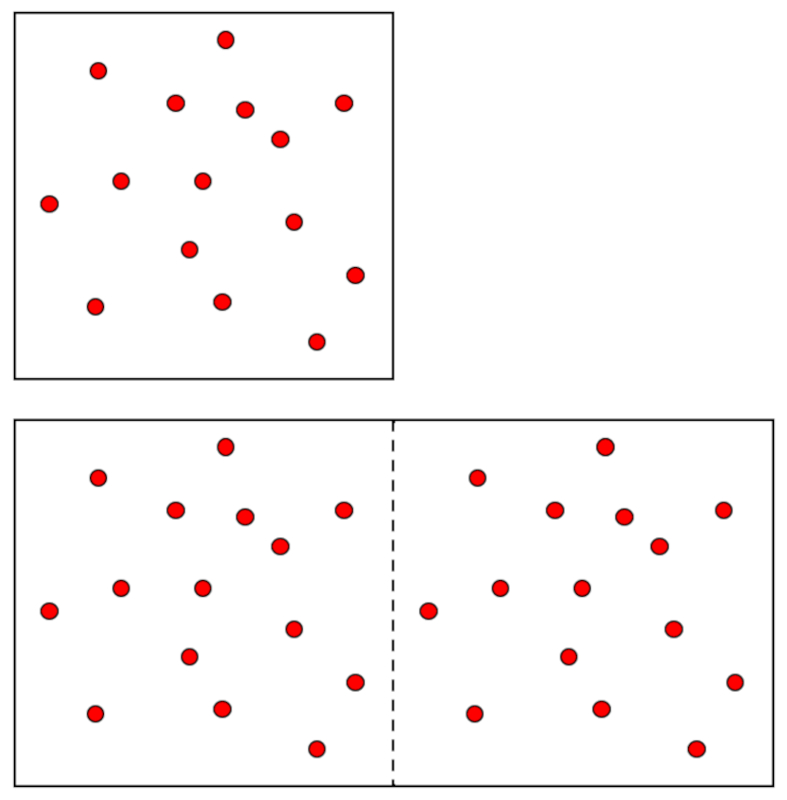
Le principe d'Avogadro stipule que des volumes gaux de gaz, la m me temp rature et pression, contiennent le m me nombre de mol cules. Cela signifie que le volume d'un gaz est directement proportionnel au nombre de mol cules (ou moles) pr sentes lorsque la temp rature et la pression sont maintenues constantes. Ce principe est fondamental pour comprendre le comportement des gaz et forme la base de la loi des gaz parfaits. Il permet de d terminer la quantit de gaz dans un volume donn et est essentiel pour les calculs impliquant des r actions chimiques et des m langes de gaz.
Il existe des variables intensives et extensives. Les premi res sont propres l' tat du syst me et ne d pendent pas de sa taille. Deux exemples sont a pression ($p$) et a température absolue ($T$). Si nous voulons un syst me plus grand dans le m me tat, la fois a pression ($p$) et a température absolue ($T$) doivent rester inchang es.
La situation est diff rente avec le volume ($V$), qui est une variable extensive, ce qui signifie que si un syst me plus grand est requis, elle devra augmenter dans la proportion correspondante. Il en va de m me pour le nombre total de grains de beauté ($n$) :
De plus, les deux doivent augmenter dans la m me proportion, donc si a pression ($p$) et a température absolue ($T$) sont constantes, elles seront proportionnelles entre elles :
$n \propto V$
Dans un gaz, lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants, une relation proportionnelle est observ e entre le volume ($V$) et le nombre de taupes ($n$). chaque augmentation de le volume ($V$), on constate galement une augmentation correspondante de le nombre de taupes ($n$), et vice versa,
$n \propto V$
comme illustr dans le graphique suivant :
La loi d'Avogadro [1] stipule que le volume ($V$) et le nombre de taupes ($n$) sont directement proportionnels lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants.
Cette relation peut tre exprim e comme suit, en utilisant a constante du principe d'Avogadro ($C_a$) :
![]() [1] "Essai sur une m thode de d termination des masses relatives des mol cules l mentaires des corps et des proportions selon lesquelles elles entrent dans ces combinaisons," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Essai sur une m thode de d termination des masses relatives des mol cules l mentaires des corps et des proportions selon lesquelles elles entrent dans ces combinaisons," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
Amadeo Avogadro, dont le nom complet est Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, tait un scientifique italien n le 9 ao t 1776 et d c d le 9 juillet 1856. Avogadro est principalement connu pour ses contributions au d veloppement de la th orie mol culaire et la formulation de la loi d'Avogadro. Il a propos que des volumes gaux de gaz, la m me temp rature et pression, contiennent le m me nombre de particules, ce qui est maintenant connu sous le nom de principe d'Avogadro ou loi d'Avogadro. Ce concept a t fondamental pour le d veloppement du concept de mole et a jet les bases de la compr hension des relations entre la quantit de substance, le volume et le nombre de particules dans les gaz. Malgr ses contributions importantes, le travail d'Avogadro n'a pas t largement reconnu de son vivant, et ses id es ont t accept es plus tard, apr s sa mort. Aujourd'hui, Avogadro est honor pour ses contributions fondamentales la chimie et est consid r comme l'un des pionniers de la th orie mol culaire moderne.
Le principe d'Avogadro tablit que lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants, le rapport de ERROR:6679 Le volume ($V$) est gal a constante du principe d'Avogadro ($C_a$) :
Cela signifie que si un gaz passe d'un tat initial (le nombre de taupes dans l'état i ($n_i$) et le volume à l'état i ($V_i$)) un tat final (le nombre de taupes dans l'état f ($n_f$) et le volume à l'état f ($V_f$)) tout en maintenant a pression ($p$) et a température absolue ($T$) constants, la loi de Gay-Lussac doit toujours tre respect e :
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Par cons quent, nous avons :
La loi d'Avogadro stipule que le volume ($V$) et le nombre de taupes ($n$) sont directement proportionnels lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants.
Cette relation peut tre exprim e comme suit, en utilisant a constante du principe d'Avogadro ($C_a$) :
La loi d'Avogadro stipule que le volume ($V$) et le nombre de taupes ($n$) sont directement proportionnels lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants.
Cette relation peut tre exprim e comme suit, en utilisant a constante du principe d'Avogadro ($C_a$) :
Si un gaz passe d'un tat initial (i) un tat final (f) en maintenant constantes a pression ($p$) et a température absolue ($T$), alors pour le nombre de taupes dans l'état i ($n_i$), le volume à l'état i ($V_i$), le nombre de taupes dans l'état f ($n_f$) et le volume à l'état f ($V_f$) s'applique :
ID:(1475, 0)