O Ciclo Diesel
Descrição 
Variáveis
Cálculos
Cálculos
Equações
Seguindo uma analogia ao ERROR:5219,0 para l quidos e s lidos com la capacidade calórica ($C$) e la massa ($M$):
| $ c =\displaystyle\frac{ C }{ M }$ |
existe tamb m um calor específico dos gases a volume constante ($c_V$) para aquecimento a volume constante com la capacidade térmica em volume constante ($C_V$):
| $ c_V =\displaystyle\frac{ C_V }{ M }$ |
(ID 11113)
Seguindo uma analogia ao ERROR:5219,0 para l quidos e s lidos com la capacidade calórica ($C$) e la massa ($M$):
| $ c =\displaystyle\frac{ C }{ M }$ |
existe tamb m um calor específico a pressão constante ($c_p$) para o aquecimento a press o constante com la capacidade térmica a pressão constante ($C_p$):
| $ c_p =\displaystyle\frac{ C_p }{ M }$ |
(ID 11114)
Ao fornecer o calor fornecido ($Q_H$), a temperatura do g s aumenta de $T_2$ para $T_3$ em um processo isob rico ( press o constante). Isso implica que podemos utilizar a rela o para ERROR:8085 com la capacidade térmica a pressão constante ($C_p$) e ERROR:7510, expressa pela equa o:
| $ \Delta Q = C_p \Delta T $ |
Isso nos leva aos valores de la temperatura no estado 3 ($T_3$) e la temperatura no estado 2 ($T_2$) usando a f rmula:
| $ Q_H = C_p ( T_3 - T_2 )$ |
(ID 11144)
Ao remover o calor absorvido ($Q_C$), a temperatura do g s aumenta de $T_1$ para $T_4$ em um processo isob rico (a press o constante). Isso implica que podemos utilizar a rela o para ERROR:8085 com la capacidade térmica em volume constante ($C_V$) e ERROR:7510, que expressa pela equa o:
| $ dU = C_V \Delta T $ |
Isso nos leva aos valores de la temperatura no estado 1 ($T_1$) e la temperatura no estado 4 ($T_4$) usando a f rmula:
| $ Q_C = C_V ( T_4 - T_1 )$ |
(ID 11145)
Dado que em uma expans o adiab tica, o g s satisfaz as rela es o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$) e o índice adiabático ($\kappa$), expressas como:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Podemos observar que durante a mudan a de estado de o volume expandido ($V_1$) e la temperatura no estado 1 ($T_1$) para o volume compactado ($V_2$) e la temperatura no estado 2 ($T_2$), a seguinte igualdade mantida:
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
Usando a equa o para o facteur de compressibilité ($r_C$):
| $ r_C =\displaystyle\frac{ V_1 }{ V_2 }$ |
Obtemos:
| $ T_2 = T_1 r_C ^{ \kappa - 1}$ |
(ID 11148)
Dado que em uma expans o adiab tica, o g s atende s rela es o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$) e o índice adiabático ($\kappa$) expressas como:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Podemos observar que na mudan a de estado de o volume intermediário ($V_3$) e la temperatura no estado 3 ($T_3$) para o volume expandido ($V_1$) e la temperatura no estado 4 ($T_4$), a seguinte igualdade se mant m:
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
Usando a equa o para o fator de expansibilidade ($r_E$):
| $ r_E =\displaystyle\frac{ V_1 }{ V_3 }$ |
Obtemos:
| $ T_3 = T_4 r_E ^{ \kappa - 1}$ |
(ID 11149)
Como o aquecimento ocorre a press o constante, aplicamos a lei de Charles:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
Portanto, a mudan a de estado ($V_2, T_2$) para ($V_3, T_3$) deve satisfazer a equa o:
$\displaystyle\frac{T_2}{V_2} = \displaystyle\frac{T_3}{V_3}$
Com as equa es:
| $ r_C =\displaystyle\frac{ V_1 }{ V_2 }$ |
| $ r_E =\displaystyle\frac{ V_1 }{ V_3 }$ |
podemos reescrever como:
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
ou seja:
| $ T_3 =\displaystyle\frac{ r_C }{ r_E } T_2 $ |
(ID 11150)
O valor de la eficiência ($\eta$) pode ser calculado usando os valores o índice adiabático ($\kappa$), la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$) na seguinte equa o:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
Al m disso, as rela es entre as temperaturas com o facteur de compressibilité ($r_C$) e o fator de expansibilidade ($r_E$) s o definidas pelas seguintes equa es:
| $ T_2 = T_1 r_C ^{ \kappa - 1}$ |
| $ T_3 = T_4 r_E ^{ \kappa - 1}$ |
| $ T_3 =\displaystyle\frac{ r_C }{ r_E } T_2 $ |
Adicionalmente, o valor de o índice adiabático ($\kappa$) utilizado na equa o:
| $ \kappa =\displaystyle\frac{ C_p }{ C_V }$ |
Essas equa es nos permitem calcular o desempenho de um processo que segue o ciclo Diesel usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ r_E ^{- \kappa }- r_C ^{- \kappa }}{ r_E ^{-1}- r_C ^{-1}}$ |
(ID 11156)
Durante uma expans o adiab tica, o g s satisfaz a rela o envolvendo o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$):
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Neste caso, do ponto inicial 3 ao ponto 4. Isso significa que, durante a expans o adiab tica, o estado do g s muda de o volume compactado ($V_2$) e la temperatura no estado 3 ($T_3$) para o volume expandido ($V_1$) e la temperatura no estado 4 ($T_4$), conforme:
| $ T_4 V_1 ^{ \kappa - 1} = T_3 V_2 ^{ \kappa - 1}$ |
(ID 11159)
Dado que em uma expans o adiab tica, o g s satisfaz a rela o com o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$) e la temperatura no estado final ($T_f$):
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Neste caso, do ponto inicial 1 ao ponto 2. Isso significa que durante a compress o adiab tica, o estado do g s muda de o volume expandido ($V_1$) e la temperatura no estado 1 ($T_1$) para o volume compactado ($V_2$) e la temperatura no estado 2 ($T_2$) da seguinte forma:
| $ T_1 V_1 ^{ \kappa - 1} = T_2 V_2 ^{ \kappa - 1}$ |
(ID 11160)
A efici ncia em rela o temperatura definida por:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
com as quantidades de calor fornecido:
| $ Q_H = C_p ( T_3 - T_2 )$ |
e absorvido:
| $ Q_C = C_V ( T_4 - T_1 )$ |
temos a rela o de efici ncia em fun o da temperatura:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 11164)
Exemplos
O ciclo Diesel um ciclo termodin mico que fundamenta o funcionamento dos motores diesel, amplamente utilizados em ve culos e maquinaria industrial. Desenvolvido por Rudolf Diesel na d cada de 1890, este ciclo distingue-se principalmente pelo seu processo de igni o em compara o com o ciclo Otto dos motores a gasolina. No ciclo Diesel, o ar aspirado para o cilindro e comprimido a uma taxa muito mais alta do que nos motores a gasolina, o que eleva sua temperatura a um ponto que pode inflamar o combust vel diesel sem a necessidade de uma vela de igni o.
Durante a opera o, o ciclo come a com o pist o puxando ar enquanto se move para baixo. Em seguida, o ar comprimido no movimento ascendente, aumentando sua temperatura. No pico da fase de compress o, o combust vel injetado no ar comprimido e quente em forma de uma fina n voa, causando igni o espont nea. A combust o empurra o pist o para baixo, gerando energia. Por fim, na fase de exaust o, os gases resultantes da combust o s o expelidos quando o pist o se move para cima novamente, completando o ciclo.
Os motores Diesel s o conhecidos por sua efici ncia e durabilidade. A alta taxa de compress o n o s permite que o motor extraia mais energia do combust vel, mas tamb m aumenta sua efici ncia t rmica, o que significa que uma maior parte da energia do combust vel convertida em trabalho mec nico. Os motores Diesel geralmente oferecem uma melhor efici ncia de combust vel e produzem menos emiss es de CO2 por unidade de energia em compara o com seus equivalentes a gasolina, mas podem emitir n veis mais altos de outros poluentes, como xidos de nitrog nio e part culas.
(ID 15283)
Sadi Carnot introduziu [1] o conceito te rico do primeiro projeto de m quina capaz de gerar trabalho mec nico com base em um gradiente de temperatura. Isso alcan ado por meio de um processo no espa o press o-volume, onde calor adicionado e extra do, conforme ilustrado na imagem:
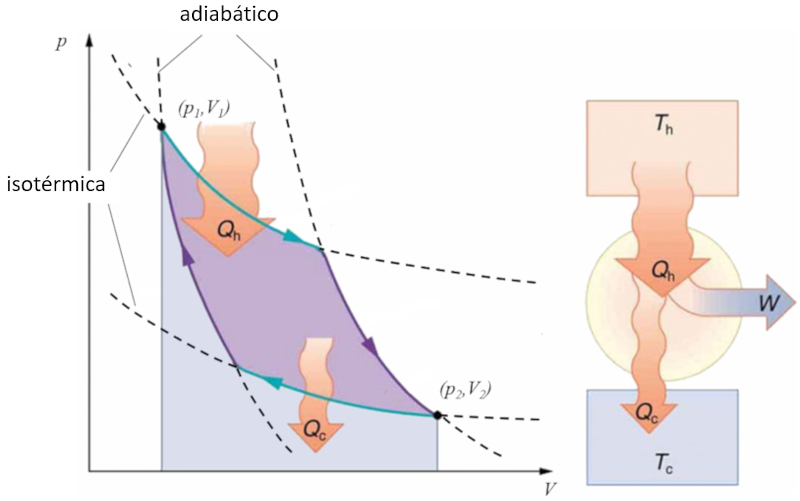
A rea sob a curva o calor fornecido ($Q_H$), que se estende de 1 a 2, representa a energia necess ria para transitar do estado ($p_1, V_1$) para o estado ($p_2, V_2$). Por outro lado, a rea sob a curva o calor absorvido ($Q_C$), indo de 2 para 1, representa a extra o de energia necess ria para retornar do estado ($p_2, V_2$) ao estado ($p_1, V_1$). A diferen a entre essas reas corresponde regi o delimitada por ambas as curvas e representa o trabalho eficaz ($W$) que o sistema pode realizar.
Carnot tamb m demonstrou que, de acordo com a segunda lei da termodin mica, o calor fornecido ($Q_H$) n o pode ser igual a zero. Isso implica que n o existem m quinas capazes de converter todo o calor em trabalho.
![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflex es sobre a Pot ncia Motriz do Fogo e sobre M quinas Adequadas para Desenvolver Essa Pot ncia), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflex es sobre a Pot ncia Motriz do Fogo e sobre M quinas Adequadas para Desenvolver Essa Pot ncia), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
(ID 11131)
Rudolf Diesel [1] prop s criar um ciclo distinto do ciclo de Carnot com o objetivo de alcan ar uma efici ncia superior em compara o com o ciclo de Otto. Esse processo se desenrola nas seguintes etapas:
• Est gio 1 a 2: Compress o adiab tica $(p_1,V_1,T_1)\rightarrow (p_2,V_2,T_2)$,
• Est gio 2 a 3: Aquecimento e expans o press o constante $(p_2,V_2,T_2)\rightarrow (p_2,V_3,T_3)$,
• Est gio 3 a 4: Expans o adiab tica $(p_2,V_3,T_3)\rightarrow (p_3,V_1,T_4)$,
• Est gio 4 a 1: Resfriamento a volume constante $(p_3,V_1,T_4)\rightarrow (p_1,V_1,T_1)$
Esses est gios s o ilustrados abaixo:
A chave est no est gio 2 a 3, onde a expans o ocorre press o constante. A raz o torna-se evidente ao examinarmos o gr fico:
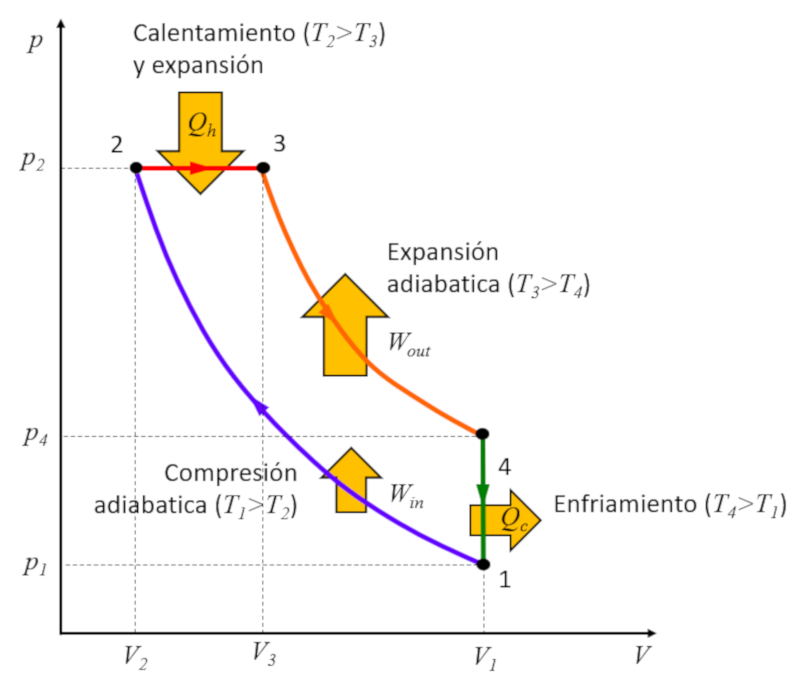
A energia ganha igual rea contida dentro do ciclo, e ao realizar a compress o press o constante, essa rea maior do que no caso da compress o a volume constante.
![]() [1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M todo para o Desenvolvimento de um Motor T rmico Racional para Substituir a M quina a Vapor e os Motores de Combust o Contempor neos), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
[1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M todo para o Desenvolvimento de um Motor T rmico Racional para Substituir a M quina a Vapor e os Motores de Combust o Contempor neos), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
(ID 11141)
Tanto o ciclo Otto quanto o ciclo Diesel dependem das vari veis la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$). No entanto, no caso do ciclo Diesel, ele tamb m depende de o índice adiabático ($\kappa$), cujo valor 1,4.
No ciclo Otto, a efici ncia calculada com base na temperatura usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
J no ciclo Diesel, a efici ncia calculada com base na temperatura usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
A inclus o do fator $1/\kappa \sim 0,71$ no ciclo Diesel o torna mais eficiente em compara o com o ciclo Otto para a mesma configura o de temperatura. Isso resultado direto do aumento da rea contida na curva que representa o ciclo na representa o press o-volume.
(ID 11153)
Dado que em uma expans o adiab tica, o g s atende s rela es o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$) e o índice adiabático ($\kappa$) expressas como:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Podemos observar que na mudan a de estado de o volume intermediário ($V_3$) e la temperatura no estado 3 ($T_3$) para o volume expandido ($V_1$) e la temperatura no estado 4 ($T_4$), a seguinte igualdade se mant m:
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
Usando a equa o para o fator de expansibilidade ($r_E$):
| $ r_E =\displaystyle\frac{ V_1 }{ V_3 }$ |
Obtemos:
| $ T_3 = T_4 r_E ^{ \kappa - 1}$ |
(ID 15751)
Dado que em uma expans o adiab tica, o g s satisfaz as rela es o volume no estado i ($V_i$), o volume no estado f ($V_f$), la temperatura no estado inicial ($T_i$), la temperatura no estado final ($T_f$) e o índice adiabático ($\kappa$), expressas como:
| $ T_i V_i ^{ \kappa -1}= T_f V_f ^{ \kappa -1}$ |
Podemos observar que durante a mudan a de estado de o volume expandido ($V_1$) e la temperatura no estado 1 ($T_1$) para o volume compactado ($V_2$) e la temperatura no estado 2 ($T_2$), a seguinte igualdade mantida:
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
Usando a equa o para o facteur de compressibilité ($r_C$):
| $ r_C =\displaystyle\frac{ V_1 }{ V_2 }$ |
Obtemos:
| $ T_2 = T_1 r_C ^{ \kappa - 1}$ |
(ID 15752)
Como o aquecimento ocorre a press o constante, aplicamos a lei de Charles:
| $\displaystyle\frac{ V_i }{ T_i }=\displaystyle\frac{ V_f }{ T_f }$ |
Portanto, a mudan a de estado ($V_2, T_2$) para ($V_3, T_3$) deve satisfazer a equa o:
$\displaystyle\frac{T_2}{V_2} = \displaystyle\frac{T_3}{V_3}$
Com as equa es:
| $ r_C =\displaystyle\frac{ V_1 }{ V_2 }$ |
| $ r_E =\displaystyle\frac{ V_1 }{ V_3 }$ |
podemos reescrever como:
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
ou seja:
| $ T_3 =\displaystyle\frac{ r_C }{ r_E } T_2 $ |
(ID 15753)
A efici ncia em rela o temperatura definida por:
| $ \eta = 1-\displaystyle\frac{ Q_C }{ Q_H } $ |
com as quantidades de calor fornecido:
| $ Q_H = C_p ( T_3 - T_2 )$ |
e absorvido:
| $ Q_C = C_V ( T_4 - T_1 )$ |
temos a rela o de efici ncia em fun o da temperatura:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
(ID 15754)
O valor de la eficiência ($\eta$) pode ser calculado usando os valores o índice adiabático ($\kappa$), la temperatura no estado 1 ($T_1$), la temperatura no estado 2 ($T_2$), la temperatura no estado 3 ($T_3$) e la temperatura no estado 4 ($T_4$) na seguinte equa o:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ T_4 - T_1 }{ T_3 - T_2 }$ |
Al m disso, as rela es entre as temperaturas com o facteur de compressibilité ($r_C$) e o fator de expansibilidade ($r_E$) s o definidas pelas seguintes equa es:
| $ T_2 = T_1 r_C ^{ \kappa - 1}$ |
| $ T_3 = T_4 r_E ^{ \kappa - 1}$ |
| $ T_3 =\displaystyle\frac{ r_C }{ r_E } T_2 $ |
Adicionalmente, o valor de o índice adiabático ($\kappa$) utilizado na equa o:
| $ \kappa =\displaystyle\frac{ C_p }{ C_V }$ |
Essas equa es nos permitem calcular o desempenho de um processo que segue o ciclo Diesel usando a seguinte equa o:
| $ \eta =1-\displaystyle\frac{1}{ \kappa }\displaystyle\frac{ r_E ^{- \kappa }- r_C ^{- \kappa }}{ r_E ^{-1}- r_C ^{-1}}$ |
(ID 15755)
(ID 15342)
ID:(1487, 0)
