Colisões entre Partículas
Storyboard 
Variáveis
Cálculos
Cálculos
Equações
Dado la concentração de partículas ($c_n$) com o número de partículas ($N$) e o volume ($V$), temos:
Com la massa molar ($m$) e la massa ($M$),
Como la densidade ($\rho$)
obtemos
$c_n=\displaystyle\frac{N}{V}=\displaystyle\frac{M}{mV}=\displaystyle\frac{\rho}{m}$
Portanto,
Exemplos
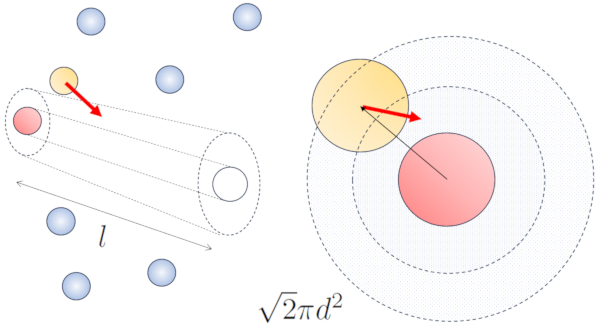
Quando part culas vizinhas est o em movimento, h uma maior probabilidade de colis o devido ao fato de que elas percorrem uma dist ncia maior no mesmo intervalo de tempo. As componentes de velocidade, $v_x$, $v_y$ e $v_z$, flutuam em torno de valores m dios $\sqrt{\langle v_x^2\rangle}$, $\sqrt{\langle v_y^2\rangle}$ e $\sqrt{\langle v_z^2\rangle}$. Supondo que o sistema seja isotr pico, a m dia de cada componente ser igual a $\displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}$. Portanto, ao longo do eixo ao qual a part cula est se movendo, ela percorrer uma dist ncia
$\sqrt{\langle v_z^2\rangle}dt=\displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}dt$
Ao mesmo tempo, as part culas que se movem perpendicularmente ter o percorrido uma dist ncia:
$\sqrt{\langle v_x^2\rangle+\langle v_y^2\rangle}dt=\displaystyle\frac{\sqrt{2}}{3}\sqrt{\langle v^2\rangle}dt$
Portanto, a probabilidade de colis o aumenta em um fator de $\sqrt{2}$ em compara o com o caso em que as part culas n o est o em movimento:
O caminho m dio livre pode ser estimado em termos do di metro de um cilindro imagin rio que envolve uma part cula, em m dia, tendo uma colis o com outra part cula.
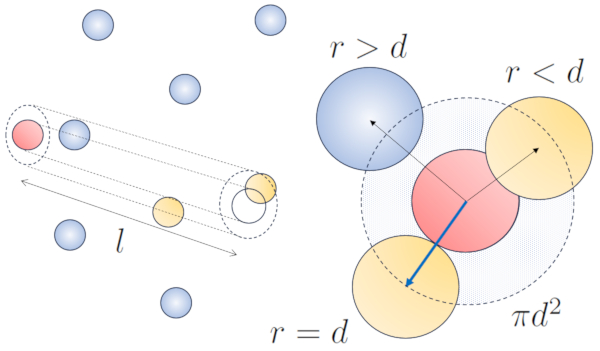
O raio do cilindro corresponde dist ncia m xima que duas part culas devem ter para colidir, o que equivale a duas vezes o raio da part cula, ou seja, o diâmetro de partícula ($d$). Como apenas uma colis o ocorre dentro deste cilindro, o n mero de part culas contidas nele deve ser igual a um. Isso significa que:
$l d^2\pi c_n= 1$
com la concentração de partículas ($c_n$), e resolvendo para o camino livre ($\bar{l}$), obtemos:
Isso representa o caminho m dio livre.
Uma vez que o di metro da part cula $d$ o dobro do raio $a$
$d=2a$
e a concentra o de part culas $c_N$ pode ser expressa em termos de concentra o molar $c_n$ como
$c_N=N_Ac_n$
onde $N_A$ o n mero de Avogadro, a equa o para o caminho livre m dio
$l=\displaystyle\frac{1}{4a^2\pi c_N}$
tamb m pode ser escrita como:
Quando uma part cula de um g s se move, ela interage com outras part culas. A forma mais simples dessa intera o atrav s de colis es el sticas, o que significa que a part cula colide sem perder energia, mudando sua dire o para impactar outra part cula.
Dentro desse processo, faz sentido definir o camino livre ($\bar{l}$), cujo valor depender de uma concentração de partículas ($c_n$).
Quando uma mol cula se move periodicamente atrav s do volume que cont m o g s, eventualmente ela encontrar outra mol cula e poder ocorrer uma colis o. A dist ncia que ela percorre entre duas colis es consecutivas chamada de 'caminho livre m dio'.
Quando uma part cula com um raio dado se move pelo espa o, ela efetivamente ocupa o espa o de um cilindro com o mesmo raio. Para que uma part cula colida com outra, a segunda deve ter parte de seu volume dentro desse cilindro. No caso mais extremo, a segunda part cula est localizada a uma dist ncia de dois raios da primeira, de modo que a borda do cilindro toca um ponto na esfera mais pr xima ao eixo do cilindro. O centro dessa esfera est a uma dist ncia igual a um raio da superf cie do cilindro:
Portanto, a dist ncia entre o eixo do cilindro e o centro de qualquer part cula de dois raios, ou seja, um di metro. Em ess ncia, pode-se imaginar que o volume ocupado literalmente pela part cula que se desloca pelo espa o um cilindro com um comprimento igual ao caminho livre e um raio igual ao di metro da pr pria part cula.
Se dividirmos la densidade ($\rho$) por la massa molar ($m$), obteremos la concentração de partículas ($c_n$):
Para converter a la concentração molar ($c_m$) em la concentração de partículas ($c_n$), basta multiplicar a primeira por o número de Avogrado ($N_A$), assim:
La concentração molar ($c_m$) corresponde a ERROR:9339,0 dividido por o volume ($V$) de um g s e calculado da seguinte forma:
No caso sem movimento, a probabilidade de o camino livre ($\bar{l}$), enquanto com movimento, as probabilidades s o de o diâmetro de partícula ($d$) e la concentração de partículas ($c_n$), respectivamente.
No caso de movimento, a probabilidade aumenta em um fator de $\sqrt{2}$, o que significa que o caminho livre
ID:(1496, 0)