Choques entre Partículas
Storyboard 
La forma mas básica de interacción son los choques entre las partículas. Estas dependerán del tamaño de las partículas y la concentración de estas.
ID:(1496, 0)
Choques entre Partículas
Storyboard 
La forma mas básica de interacción son los choques entre las partículas. Estas dependerán del tamaño de las partículas y la concentración de estas.
Variables
Cálculos
Cálculos
Ecuaciones
Dado la concentración de particulas ($c_n$) con el número de partículas ($N$) y el volumen ($V$), obtenemos:
Con la masa de la partícula ($m$) y la masa ($M$),
Como la densidad ($\rho$) es
obtenemos
$c_n=\displaystyle\frac{N}{V}=\displaystyle\frac{M}{mV}=\displaystyle\frac{\rho}{m}$
Por lo tanto,
Ejemplos
Dado que el di metro de la part cula $d$ es el doble del radio $a$
$d=2a$
y la concentraci n de part culas $c_N$ se puede expresar en t rminos de la concentraci n molar $c_n$ como
$c_N=N_Ac_n$
donde $N_A$ es el n mero de Avogadro, la ecuaci n del camino libre
$l=\displaystyle\frac{1}{4a^2\pi c_N}$
tambi n se puede expresar como:
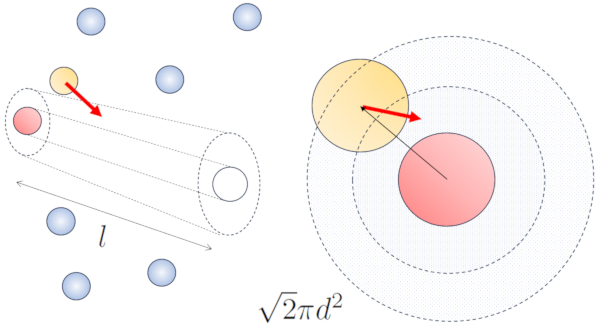
El camino libre medio se puede estimar en funci n del di metro de un cilindro imaginario que rodea una part cula, teniendo en promedio una colisi n con otra part cula.
El radio del cilindro corresponde a la distancia m xima que dos part culas deben tener para colisionar, lo que equivale a dos veces el radio de la part cula, es decir, el diámetro de la partícula ($d$). Dado que solo ocurre una colisi n en este cilindro, el n mero de part culas contenidas en l debe ser igual a uno. Esto significa que:
$l d^2\pi c_n= 1$
con la concentración de particulas ($c_n$) y resolviendo para el camino libre ($\bar{l}$), obtenemos:
Esto representa el camino libre medio.
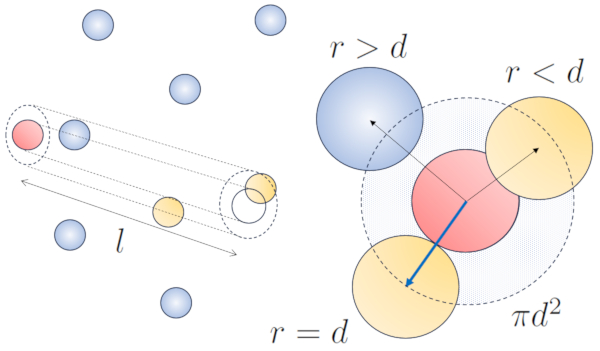
Cuando las part culas vecinas est n en movimiento, existe una mayor probabilidad de colisi n debido a que durante el mismo intervalo de tiempo, recorren una mayor distancia. Las componentes de velocidad, $v_x$, $v_y$, y $v_z$, fluct an alrededor de valores medios $\sqrt{\langle v_x^2\rangle}$, $\sqrt{\langle v_y^2\rangle}$ y $\sqrt{\langle v_z^2\rangle}$. Si asumimos que el sistema es isotr pico, el promedio de cada componente ser igual a $\displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}$. Por lo tanto, en el eje a lo largo del cual se desplaza la part cula, recorrer una distancia
$\sqrt{\langle v_z^2\rangle}dt=\displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}dt$
Al mismo tiempo, las part culas que se desplazan perpendicularmente habr n recorrido una distancia:
$\sqrt{\langle v_x^2\rangle+\langle v_y^2\rangle}dt=\displaystyle\frac{\sqrt{2}}{3}\sqrt{\langle v^2\rangle}dt$
Por lo tanto, la probabilidad de colisi n aumentar en un factor de $\sqrt{2}$ en comparaci n con el caso en el que las part culas no se desplazan:
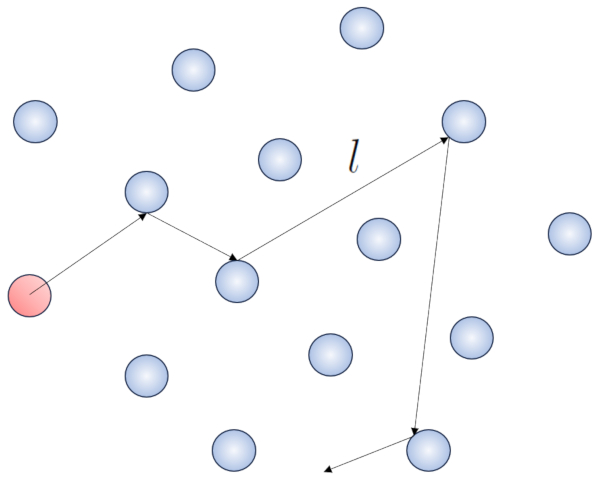
Cuando una mol cula se desplaza peri dicamente a trav s del volumen que contiene el gas, eventualmente se encontrar con otra mol cula y podr n chocar. La distancia que recorre entre dos choques consecutivos se denomina 'camino libre medio'.
Cuando una part cula de un gas se desplaza, interact a con las dem s part culas en su entorno. La forma m s simple de esta interacci n es a trav s de choques el sticos, lo que significa que la part cula choca sin perder energ a, cambiando su direcci n para luego impactar con otra part cula.
Dentro de este proceso, tiene sentido definir el camino libre ($\bar{l}$), cuyo valor depender de una concentración de particulas ($c_n$).
Para el caso sin movimiento, la probabilidad es de el camino libre ($\bar{l}$), mientras que con movimiento, las probabilidades son de el diámetro de la partícula ($d$) y la concentración de particulas ($c_n$), respectivamente.
En el caso del movimiento, la probabilidad se incrementa en un factor de $\sqrt{2}$, lo que significa que el camino libre es
Si
$l\pi d^2c_n=1$
o
Cuando una part cula de un radio dado se desplaza en el espacio, efectivamente ocupa el espacio de un cilindro con el mismo radio. Para que esta part cula colisione con otra, esta segunda debe tener parte de su volumen dentro de dicho cilindro. En el caso m s extremo, la segunda part cula se encuentra a una distancia de dos radios del primero, de manera que el borde del cilindro est en contacto con un punto de la esfera m s cercano al eje del cilindro. El centro de esta esfera se encuentra a una distancia igual a un radio desde la superficie del cilindro:
Por lo tanto, la distancia entre el eje del cilindro y el centro de cualquier part cula es de dos radios, es decir, un di metro. En otras palabras, se puede concebir que el volumen ocupado de manera literal por la part cula que se desplaza en el espacio es un cilindro con una longitud igual al camino libre y un radio igual al di metro de la propia part cula.
Si dividimos la densidad ($\rho$) por la masa de la partícula ($m$), obtendremos la concentración de particulas ($c_n$):
La concentración molar ($c_m$) corresponde al ERROR:9339,0 por el volumen ($V$) de un gas y se calcula como sigue:
Para convertir la concentración molar ($c_m$) en la concentración de particulas ($c_n$), simplemente multiplique la primera por el número de Avogadro ($N_A$), as :
ID:(1496, 0)