Loi de Boyle-Mariotte
Storyboard 
La loi de Boyle-Mariotte établit que le produit de a pression ($p$) et le volume ($V$) d'un gaz reste constant lorsque la température absolue et la quantité de matière ne varient pas.
Cela signifie que a pression ($p$) varie de manière inversement proportionnelle à Le volume ($V$).
ID:(1472, 0)
Mécanismes
Iframe 
La loi de Boyle-Mariotte, également connue sous le nom de loi de Boyle, décrit la relation inverse entre la pression et le volume d'un gaz à température constante. Elle stipule que, pour une quantité fixe de gaz, lorsque la température est maintenue constante, la pression du gaz augmente à mesure que le volume diminue, et vice-versa. Cela signifie que si vous compressez un gaz en réduisant son volume, sa pression augmentera proportionnellement, et si vous augmentez le volume, la pression diminuera proportionnellement. Cette relation est fondamentale pour comprendre le comportement des gaz et s'exprime mathématiquement par le produit de la pression et du volume étant une constante pour une quantité de gaz donnée à température constante.
Mécanismes
ID:(15254, 0)
Variation de volume et de pression
Concept 
A pression ($p$) est généré lorsque les particules de gaz entrent en collision avec la surface du contenant de gaz. Comme a température absolue ($T$) est constant, l'énergie des particules ne varie pas et les chocs de celles-ci avec les surfaces du contenant de gaz ne varieront pas dans le transfert d'impulsion. Cependant, le nombre d'impacts dépend du nombre de particules près de la surface, qui à son tour est proportionnel au a concentration de particules ($c_n$) du gaz.
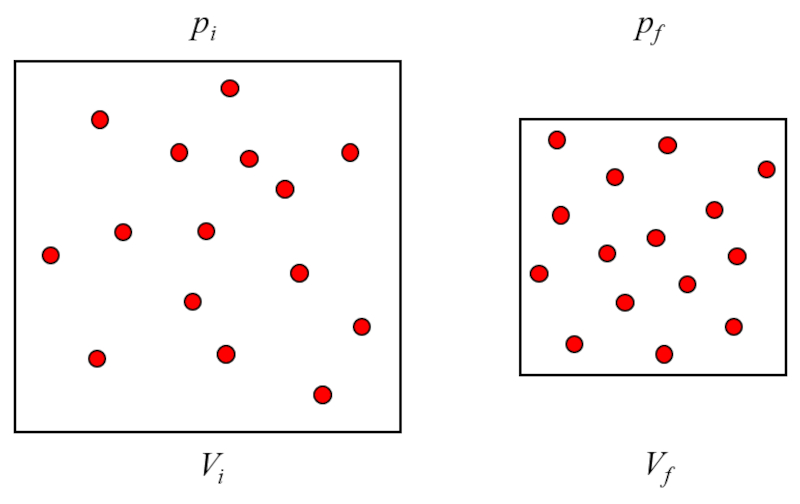
D'autre part, la densité est inversement proportionnelle à Le volume ($V$), ce qui conduit à la relation suivante :
$p \propto c_n \propto \displaystyle\frac{1}{V}$
ID:(9602, 0)
Relation volume et pression
Description 
Dans un gaz, si à la fois a température absolue ($T$) et le nombre de particules ($N$) sont maintenus constants, on observe que le volume ($V$) et a pression ($p$) varient de manière inversement proportionnelle. Chaque fois que le volume ($V$) est réduit, a pression ($p$) augmente, et vice versa,
$p \propto \displaystyle\frac{1}{V}$
comme illustré dans le graphique suivant :
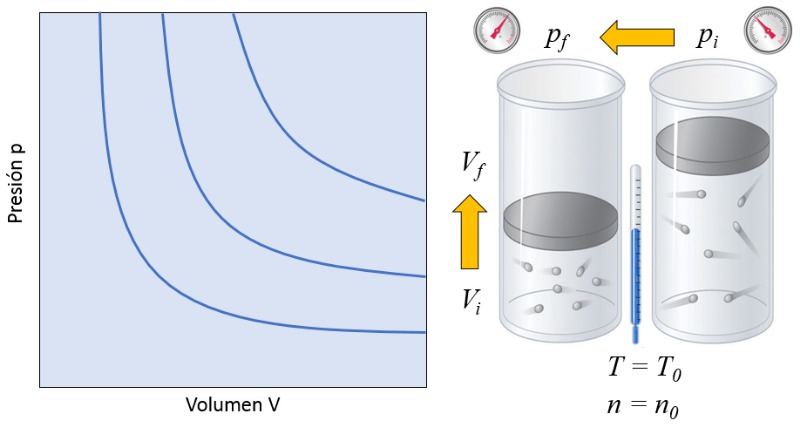
La relation entre le nombre de particules ($N$) et a température absolue ($T$) est que leur produit est égal à Une constante de la loi de Boyle ($C_b$), ce qui correspond à la loi de Boyle [1], en l'honneur de son découvreur Robert Boyle :
| $ p V = C_b $ |
On parle parfois de la loi de Boyle-Mariotte, en souvenir du physicien français Edme Mariotte qui a découvert la même loi de manière indépendante en 1676.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-mécaniques, concernant la résilience de l'air et ses effets), Robert Boyle, Oxford : imprimé par H. Hall, imprimeur de l'université, pour Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-mécaniques, concernant la résilience de l'air et ses effets), Robert Boyle, Oxford : imprimé par H. Hall, imprimeur de l'université, pour Tho. Robinson (1660).
ID:(9531, 0)
Robert Boyle
Description 
Robert Boyle était un scientifique irlandais né en 1627. Il est considéré comme l'un des fondateurs de la chimie moderne et est connu pour ses contributions dans le domaine du comportement des gaz. La relation entre Robert Boyle et la loi de Boyle vient du fait qu'il a formulé cette loi au XVIIe siècle. La loi de Boyle établit que, à température constante, le volume d'un gaz est inversement proportionnel à sa pression. Boyle a réalisé des expériences qui ont démontré cette relation et jeté les bases de la compréhension du comportement des gaz.

ID:(1657, 0)
Changement d'état d'un gaz parfait selon la loi de Boyle
Concept 
La loi de Boyle stipule que, avec a température absolue ($T$) constant, le produit de a pression ($p$) et le volume ($V$) est égal à A constante de la loi de Boyle ($C_b$) :
| $ p V = C_b $ |
Cela signifie que si un gaz passe d'un état initial (a pression à l'état initial ($p_i$) et le volume à l'état i ($V_i$)) à un état final (a pression à l'état final ($p_f$) et le volume à l'état f ($V_f$)), en maintenant a température absolue ($T$) constant, il doit toujours respecter la loi de Boyle :
$p_i V_i = C_b = p_f V_f$
Par conséquent, on a :
| $ p_i V_i = p_f V_f $ |
ID:(15688, 0)
Équivalent à la loi de Boyle pour les densités
Concept 
Si, dans un changement isotherme où le contenu ne varie pas, a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) sont liés par :
| $ p_i V_i = p_f V_f $ |
Alors, nous pouvons introduire a densité ($\rho$) qui, avec a masse ($M$) et le volume ($V$), satisfait :
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
Ce qui nous amène à A densité dans l'état i ($\rho_i$) et a densité dans l'état f ($\rho_f$) comme suit :
| $\displaystyle\frac{ p_i }{ \rho_i } = \displaystyle\frac{ p_f }{ \rho_f }$ |
ID:(15687, 0)
Modèle
Top 
Paramètres
Variables
Calculs
Calculs
Calculs
Équations
$ p_i V_i = C_b $
p * V = C_b
$ p_f V_f = C_b $
p * V = C_b
$ p_i V_i = p_f V_f $
p_i * V_i = p_f * V_f
$\displaystyle\frac{ p_i }{ \rho_i } = \displaystyle\frac{ p_f }{ \rho_f }$
p_i / rho_i = p_f / rho_f
$ \rho_i \equiv\displaystyle\frac{ M }{ V_i }$
rho = M / V
$ \rho_f \equiv\displaystyle\frac{ M }{ V_f }$
rho = M / V
ID:(15313, 0)
La loi de Boyle (1)
Équation 
La loi de Boyle établit une relation entre le volume ($V$) et a pression ($p$), en indiquant que leur produit est égal à A constante de la loi de Boyle ($C_b$), de la manière suivante :
ID:(582, 1)
La loi de Boyle (2)
Équation 
La loi de Boyle établit une relation entre le volume ($V$) et a pression ($p$), en indiquant que leur produit est égal à A constante de la loi de Boyle ($C_b$), de la manière suivante :
ID:(582, 2)
Changement d'état d'un gaz parfait selon la loi de Boyle
Équation 
Si un gaz passe d'un état initial (i) à un état final (f) avec a température absolue ($T$) constant, la relation suivante est valable pour a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) :
La loi de Boyle stipule que, avec a température absolue ($T$) constant, le produit de a pression ($p$) et le volume ($V$) est égal à A constante de la loi de Boyle ($C_b$) :
| $ p V = C_b $ |
Cela signifie que si un gaz passe d'un état initial (a pression à l'état initial ($p_i$) et le volume à l'état i ($V_i$)) à un état final (a pression à l'état final ($p_f$) et le volume à l'état f ($V_f$)), en maintenant a température absolue ($T$) constant, il doit toujours respecter la loi de Boyle :
$p_i V_i = C_b = p_f V_f$
Par conséquent, on a :
| $ p_i V_i = p_f V_f $ |
ID:(3491, 0)
Masse et Densité (1)
Équation 
A densité ($\rho$) est défini comme le rapport entre a masse ($M$) et le volume ($V$), exprimé comme suit :
Cette propriété est spécifique au matériau en question.
ID:(3704, 1)
Masse et Densité (2)
Équation 
A densité ($\rho$) est défini comme le rapport entre a masse ($M$) et le volume ($V$), exprimé comme suit :
Cette propriété est spécifique au matériau en question.
ID:(3704, 2)
Équivalent à la loi de Boyle pour les densités
Équation 
La loi de Boyle pour l'état initial (a densité dans l'état i ($\rho_i$), a pression à l'état initial ($p_i$)) et l'état final (a densité dans l'état f ($\rho_f$), a pression à l'état final ($p_f$)) s'exprime comme suit :
Si, dans un changement isotherme où le contenu ne varie pas, a pression à l'état initial ($p_i$), a pression à l'état final ($p_f$), le volume à l'état i ($V_i$) et le volume à l'état f ($V_f$) sont liés par :
| $ p_i V_i = p_f V_f $ |
Alors, nous pouvons introduire a densité ($\rho$) qui, avec a masse ($M$) et le volume ($V$), satisfait :
| $ \rho \equiv\displaystyle\frac{ M }{ V }$ |
Ce qui nous amène à A densité dans l'état i ($\rho_i$) et a densité dans l'état f ($\rho_f$) comme suit :
| $\displaystyle\frac{ p_i }{ \rho_i } = \displaystyle\frac{ p_f }{ \rho_f }$ |
ID:(8834, 0)
