Diagrama de fase da água
Conceito 
Um dos diagramas de fase mais relevantes para o nosso planeta é o da água. Este diagrama apresenta as três fases clássicas: sólida, líquida e gasosa, além de várias fases com diferentes estruturas cristalinas do gelo.
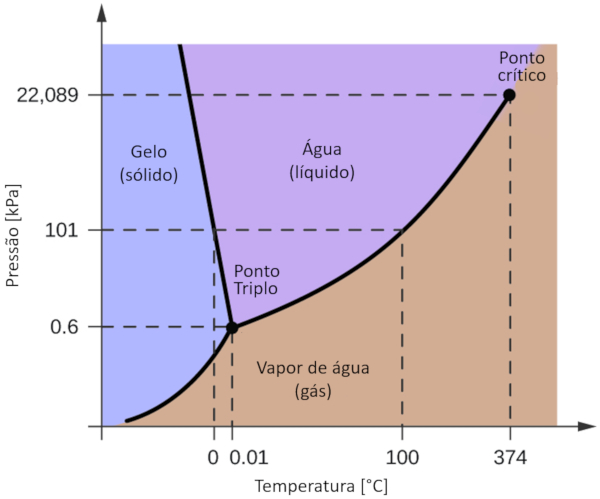
A diferença significativa em relação a outros materiais é que, dentro de uma faixa de pressão que varia de 611 Pa a 209,9 MPa, o estado sólido ocupa um volume maior do que o estado líquido. Essa característica é refletida no diagrama de fase como uma inclinação negativa ao longo da linha de separação entre o estado sólido (gelo hexagonal) e o estado líquido (água).
Esse fenômeno pode ser explicado pela equação de Clausius-Clapeyron:
Neste caso, mostra uma variação negativa no volume:
\Delta v=v_{água}-v_{gelo}= 18,015,ml/mol-19,645,ml/mol=-1,63,ml/mol<0
Essa propriedade leva a situações em que, devido à falta de espaço para expansão, a água não congela, preservando a vida contida nela. Por outro lado, a pressão gerada pelo fato de o gelo ocupar mais volume é um dos principais mecanismos de erosão na Terra.
ID:(836, 0)
Lei de Clausius Clapeyron
Conceito 
Se o diferencial de energia livre de Gibbs (dG) é constante, isso significa que para la variação de pressão (dp) e la variação de temperatura (dT), os valores de la entropia (S) e o volume (V) na fase 1
dG = -S_1dT+V_1dp
e la entropia (S) e o volume (V) na fase 2
dG = -S_2dT+V_2dp
resultam em
\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}
A mudança em la entropia (S) entre ambas as fases corresponde a o calor latente (L) dividido por la temperatura absoluta (T):
S_2 - S_1 =\displaystyle\frac{ L }{ T }
Então, com a definição de la variação de volume na mudança de fase (\Delta V)
\Delta V \equiv V_2 - V_1
obtemos a equação de Clausius-Clapeyron [1,2,3]
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T } |
![]() [1] "Über die Art der Bewegung, welche wir Wärme nennen" (Sobre o Tipo de Movimento que Chamamos Calor), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
[1] "Über die Art der Bewegung, welche wir Wärme nennen" (Sobre o Tipo de Movimento que Chamamos Calor), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
![]() [2] "Ueber eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sobre uma Forma Modificada da Segunda Lei da Teoria Mecânica do Calor), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
[2] "Ueber eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sobre uma Forma Modificada da Segunda Lei da Teoria Mecânica do Calor), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
![]() [3] "Mémoire sur la puissance motrice de la chaleur" (Memória sobre o Poder Motriz do Calor), Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
[3] "Mémoire sur la puissance motrice de la chaleur" (Memória sobre o Poder Motriz do Calor), Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
ID:(15765, 0)
Lei molar de Clausius Clapeyron
Conceito 
Com a lei de Clausius-Clapeyron, que depende de la variação de pressão (dp), la variação de temperatura (dT), o calor latente (L), la variação de volume na mudança de fase (\Delta V) e la temperatura absoluta (T), expressa como:
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T } |
e a definição de o calor latente molar (l_m), onde o calor latente (L) está relacionado a la massa molar (M_m) da seguinte forma:
| l_m \equiv\displaystyle\frac{ L }{ M_m } |
e o variação do volume molar durante a mudança de fase (\Delta v_m), onde la variação de volume na mudança de fase (\Delta V) está relacionado a la massa molar (M_m) da seguinte forma:
| \Delta v_m =\displaystyle\frac{ \Delta V }{ M_m } |
obtemos:
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T } |
ID:(15766, 0)
Rudolf Clausius
Imagem 
Rudolf Clausius (1822-1888) foi um físico e matemático alemão que fez contribuições significativas no campo da termodinâmica. Ele é mais conhecido por formular o segundo princípio da termodinâmica e por introduzir o conceito de entropia como uma quantidade fundamental no estudo da transferência e transformação de energia em sistemas físicos.

ID:(1885, 0)
Modelo
Top 
Parâmetros
Variáveis
Cálculos
Cálculos
Cálculos
Equações
\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }
dp / dT = L /( DV * T )
\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }
dp / dT = l_m /( Dv_m * T )
\Delta Q = L \Delta m
DQ = L * Dm
\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }
Dv_m = DV / M_m
l_m \equiv\displaystyle\frac{ L }{ M_m }
l_m = L / M_m
ID:(15345, 0)
Calor latente específico
Equação 
La massa evaporada (\Delta m) é definido usando o calor latente (L) e o calor de mudança de fase (\Delta Q) da seguinte maneira:
ID:(3200, 0)
Lei de Clausius Clapeyron
Equação 
A lei Clausius-Clapeyron estabelece uma relação entre la variação de pressão (dp) e la variação de temperatura (dT) com o calor latente (L), la temperatura absoluta (T) e ($$)5239 < /var> da seguinte maneira:
Se o diferencial de energia livre de Gibbs (dG) é constante, significa que, para la variação de pressão (dp) e la variação de temperatura (dT), os valores de la entropia (S) e o volume (V) na fase 1
dG = -S_1dT+V_1dp
e la entropia (S) e o volume (V) na fase 2
dG = -S_2dT+V_2dp
resultam em
\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}
A mudança em la entropia (S) entre ambas as fases corresponde a o calor latente (L) dividido por la temperatura absoluta (T):
S_2 - S_1 =\displaystyle\frac{ L }{ T }
Assim, com a definição de la variação de volume na mudança de fase (\Delta V)
\Delta V \equiv V_2 - V_1
obtemos
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T } |
ID:(12824, 0)
Volume molar
Equação 
A variação de volume entre o material em dois estados diferentes pode ser expressa em mols
para obter um indicador característico do material.
ID:(12823, 0)
Lei molar de Clausius Clapeyron
Equação 
A equação de Clausius-Clapeyron estabelece uma relação entre la variação de pressão (dp) e la variação de temperatura (dT) com la temperatura absoluta (T), o calor latente molar (l_m) e ($$)9868 < /var> da seguinte maneira:
Com a lei de Clausius-Clapeyron, que depende de la variação de pressão (dp), la variação de temperatura (dT), o calor latente (L), la variação de volume na mudança de fase (\Delta V) e la temperatura absoluta (T), expressa como:
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T } |
e a definição de o calor latente molar (l_m), onde o calor latente (L) está relacionado a la massa molar (M_m) da seguinte forma:
| l_m \equiv\displaystyle\frac{ L }{ M_m } |
e o variação do volume molar durante a mudança de fase (\Delta v_m), onde la variação de volume na mudança de fase (\Delta V) está relacionado a la massa molar (M_m) da seguinte forma:
| \Delta v_m =\displaystyle\frac{ \Delta V }{ M_m } |
obtemos:
| \displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T } |
ID:(12822, 0)
