Schéma de la phase de l'eau
Image 
L'un des diagrammes de phase les plus pertinents pour notre planète est celui de l'eau. Ce diagramme présente les trois phases classiques : solide, liquide et gazeuse, ainsi que plusieurs phases avec différentes structures cristallines de la glace.
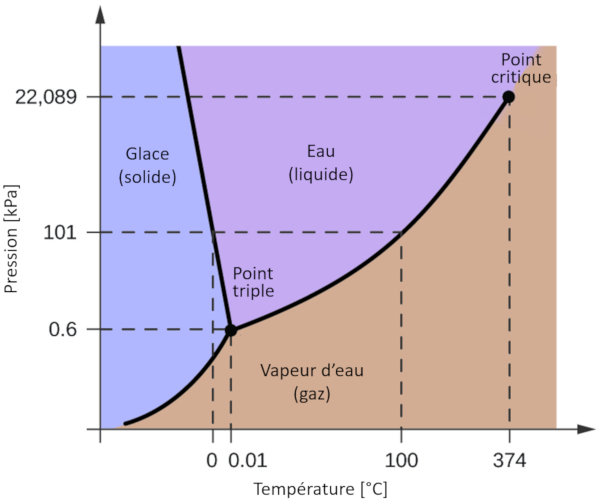
La caractéristique la plus notable par rapport à d'autres matériaux est que, dans une plage de pression allant de 611 Pa à 209,9 MPa, la phase solide occupe un volume plus important que la phase liquide. Cette particularité se reflète dans le diagramme de phase sous la forme d'une pente négative le long de la ligne de séparation entre la phase solide (glace hexagonale) et la phase liquide (eau).
ID:(836, 0)
Loi de Clausius Clapeyron
Noter 
Si le différentiel d'énergie libre de Gibbs ($dG$) est constant, cela signifie que pour a variation de pression ($dp$) et a variation de température ($dT$), les valeurs de a entropie ($S$) et le volume ($V$) dans la phase 1
$dG = -S_1dT+V_1dp$
et a entropie ($S$) et le volume ($V$) dans la phase 2
$dG = -S_2dT+V_2dp$
résultent en
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}$
Le changement de a entropie ($S$) entre les deux phases correspond à Le chaleur latente ($L$) divisé par a température absolue ($T$):
$S_2 - S_1 =\displaystyle\frac{ L }{ T }$
Puis, avec la définition de a variation de volume en changement de phase ($\Delta V$)
$\Delta V \equiv V_2 - V_1$
nous obtenons l'équation de Clausius-Clapeyron [1,2,3]
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
![]() [1] "Über die Art der Bewegung, welche wir Wärme nennen" (Sur la nature du mouvement que nous appelons chaleur), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
[1] "Über die Art der Bewegung, welche wir Wärme nennen" (Sur la nature du mouvement que nous appelons chaleur), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
![]() [2] "Ueber eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sur une forme modifiée de la seconde loi de la théorie mécanique de la chaleur), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
[2] "Ueber eine veränderte Form des zweiten Hauptsatzes der mechanischen Wärmetheorie" (Sur une forme modifiée de la seconde loi de la théorie mécanique de la chaleur), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
![]() [3] "Mémoire sur la puissance motrice de la chaleur", Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
[3] "Mémoire sur la puissance motrice de la chaleur", Benoît Paul Émile Clapeyron, Journal de l'École Royale Polytechnique, 14, 153-190. (1834)
ID:(15765, 0)
Loi molaire de Clausius Clapeyron
Citation 
Avec la loi de Clausius-Clapeyron, qui dépend de a variation de pression ($dp$), a variation de température ($dT$), le chaleur latente ($L$), a variation de volume en changement de phase ($\Delta V$) et a température absolue ($T$), exprimée comme suit :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
et la définition de le chaleur latente molaire ($l_m$), où Le chaleur latente ($L$) est lié à A masse molaire ($M_m$) comme suit :
| $ l_m \equiv\displaystyle\frac{ L }{ M_m }$ |
et le variation du volume molaire lors du changement de phase ($\Delta v_m$), où A variation de volume en changement de phase ($\Delta V$) est lié à A masse molaire ($M_m$) comme suit :
| $\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }$ |
nous obtenons :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
ID:(15766, 0)
Rudolf Clausius
Équation 
Rudolf Clausius (1822-1888) était un physicien et mathématicien allemand qui a apporté d'importantes contributions dans le domaine de la thermodynamique. Il est surtout connu pour avoir formulé le deuxième principe de la thermodynamique et pour avoir introduit le concept d'entropie en tant que quantité fondamentale dans l'étude des transferts et des transformations d'énergie dans les systèmes physiques.

ID:(1885, 0)
Cambio de Fáse
Description 
Variables
Calculs
Calculs
Équations
(ID 3200)
Avec la loi de Clausius-Clapeyron, qui d pend de a variation de pression ($dp$), a variation de température ($dT$), le chaleur latente ($L$), a variation de volume en changement de phase ($\Delta V$) et a température absolue ($T$), exprim e comme suit :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
et la d finition de le chaleur latente molaire ($l_m$), o le chaleur latente ($L$) est li a masse molaire ($M_m$) comme suit :
| $ l_m \equiv\displaystyle\frac{ L }{ M_m }$ |
et le variation du volume molaire lors du changement de phase ($\Delta v_m$), o a variation de volume en changement de phase ($\Delta V$) est li a masse molaire ($M_m$) comme suit :
| $\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }$ |
nous obtenons :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
(ID 12822)
Si le différentiel d'énergie libre de Gibbs ($dG$) est constant, cela signifie que pour a variation de pression ($dp$) et a variation de température ($dT$), les valeurs de a entropie ($S$) et le volume ($V$) en phase 1
$dG = -S_1dT+V_1dp$
et a entropie ($S$) et le volume ($V$) en phase 2
$dG = -S_2dT+V_2dp$
donnent
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}$
La variation de a entropie ($S$) entre les deux phases correspond le chaleur latente ($L$) divis par a température absolue ($T$) :
$S_2 - S_1 =\displaystyle\frac{ L }{ T }$
Ainsi, avec la d finition de a variation de volume en changement de phase ($\Delta V$)
$\Delta V \equiv V_2 - V_1$
nous obtenons
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
(ID 12824)
Exemples
(ID 15286)
L'un des diagrammes de phase les plus pertinents pour notre plan te est celui de l'eau. Ce diagramme pr sente les trois phases classiques : solide, liquide et gazeuse, ainsi que plusieurs phases avec diff rentes structures cristallines de la glace.

La caract ristique la plus notable par rapport d'autres mat riaux est que, dans une plage de pression allant de 611 Pa 209,9 MPa, la phase solide occupe un volume plus important que la phase liquide. Cette particularit se refl te dans le diagramme de phase sous la forme d'une pente n gative le long de la ligne de s paration entre la phase solide (glace hexagonale) et la phase liquide (eau).
(ID 836)
Si le différentiel d'énergie libre de Gibbs ($dG$) est constant, cela signifie que pour a variation de pression ($dp$) et a variation de température ($dT$), les valeurs de a entropie ($S$) et le volume ($V$) dans la phase 1
$dG = -S_1dT+V_1dp$
et a entropie ($S$) et le volume ($V$) dans la phase 2
$dG = -S_2dT+V_2dp$
r sultent en
$\displaystyle\frac{dp}{dT}=\displaystyle\frac{S_2-S_1}{V_2-V_1}$
Le changement de a entropie ($S$) entre les deux phases correspond le chaleur latente ($L$) divis par a température absolue ($T$):
$S_2 - S_1 =\displaystyle\frac{ L }{ T }$
Puis, avec la d finition de a variation de volume en changement de phase ($\Delta V$)
$\Delta V \equiv V_2 - V_1$
nous obtenons l' quation de Clausius-Clapeyron [1,2,3]
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
![]() [1] " ber die Art der Bewegung, welche wir W rme nennen" (Sur la nature du mouvement que nous appelons chaleur), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
[1] " ber die Art der Bewegung, welche wir W rme nennen" (Sur la nature du mouvement que nous appelons chaleur), Rudolf Clausius, Annalen der Physik und Chemie, 155(6), 368-397. (1850)
![]() [2] "Ueber eine ver nderte Form des zweiten Hauptsatzes der mechanischen W rmetheorie" (Sur une forme modifi e de la seconde loi de la th orie m canique de la chaleur), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
[2] "Ueber eine ver nderte Form des zweiten Hauptsatzes der mechanischen W rmetheorie" (Sur une forme modifi e de la seconde loi de la th orie m canique de la chaleur), Rudolf Clausius, Annalen der Physik, 176(3), 353-400. (1857)
![]() [3] "M moire sur la puissance motrice de la chaleur", Beno t Paul mile Clapeyron, Journal de l' cole Royale Polytechnique, 14, 153-190. (1834)
[3] "M moire sur la puissance motrice de la chaleur", Beno t Paul mile Clapeyron, Journal de l' cole Royale Polytechnique, 14, 153-190. (1834)
(ID 15765)
Avec la loi de Clausius-Clapeyron, qui d pend de a variation de pression ($dp$), a variation de température ($dT$), le chaleur latente ($L$), a variation de volume en changement de phase ($\Delta V$) et a température absolue ($T$), exprim e comme suit :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
et la d finition de le chaleur latente molaire ($l_m$), o le chaleur latente ($L$) est li a masse molaire ($M_m$) comme suit :
| $ l_m \equiv\displaystyle\frac{ L }{ M_m }$ |
et le variation du volume molaire lors du changement de phase ($\Delta v_m$), o a variation de volume en changement de phase ($\Delta V$) est li a masse molaire ($M_m$) comme suit :
| $\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }$ |
nous obtenons :
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
(ID 15766)
Rudolf Clausius (1822-1888) tait un physicien et math maticien allemand qui a apport d'importantes contributions dans le domaine de la thermodynamique. Il est surtout connu pour avoir formul le deuxi me principe de la thermodynamique et pour avoir introduit le concept d'entropie en tant que quantit fondamentale dans l' tude des transferts et des transformations d' nergie dans les syst mes physiques.

(ID 1885)
(ID 15345)
A masse évaporée ($\Delta m$) est d fini en utilisant le chaleur latente ($L$) et le chaleur à changement de phase ($\Delta Q$) de la mani re suivante :
| $ \Delta Q = L \Delta m$ |
(ID 3200)
La loi Clausius-Clapeyron tablit une relation entre a variation de pression ($dp$) et a variation de température ($dT$) avec le chaleur latente ($L$), a température absolue ($T$) et ERROR:5239 < /var> comme suitxa0:
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ L }{ \Delta V T }$ |
(ID 12824)
(ID 9273)
La variation de volume entre le mat riau deux tats diff rents peut tre exprim e en moles
| $\Delta v_m =\displaystyle\frac{ \Delta V }{ M_m }$ |
pour obtenir un indicateur caract ristique du mat riau.
(ID 12823)
L' quation de Clausius-Clapeyron tablit une relation entre a variation de pression ($dp$) et a variation de température ($dT$) avec a température absolue ($T$), le chaleur latente molaire ($l_m$) et ERROR:9868 < /var> comme suitxa0:
| $\displaystyle\frac{ dp }{ dT }=\displaystyle\frac{ l_m }{ \Delta v_m T }$ |
(ID 12822)
ID:(316, 0)
