Pressão
Conceito 
A pressão é o resultado das múltiplas colisões das partículas de gás com as paredes do recipiente. Cada colisão contribui para a pressão total exercida pelo gás. Quanto mais rápido as partículas se movem e quantas mais colisões ocorrem em um determinado período de tempo, maior será a pressão.
ID:(9599, 0)
Volume
Conceito 
O volume é uma propriedade fundamental de um gás e pode ser entendido como o espaço tridimensional que o gás ocupa em um recipiente.
ID:(9601, 0)
Os mols
Conceito 
Ao utilizar o conceito de mol, podemos relacionar diretamente a quantidade de substância de um gás com o número de partículas de o número de partículas ($N$) presentes nele. Isso simplifica os cálculos e permite estabelecer uma conexão mais intuitiva entre a quantidade de gás e suas propriedades definidoras, como la pressão ($p$), o volume ($V$) e la temperatura absoluta ($T$).
A constante o número de Avogrado ($N_A$), que é aproximadamente igual a $6,02\times 10^{23}$, é uma constante fundamental na química e é usada para fazer conversões entre a escala macroscópica e a escala microscópica de átomos e moléculas.
O valor de ERROR:5394 pode ser calculado a partir de o número de partículas ($N$) e la massa ($M$). No primeiro caso, é obtido dividindo por ERROR:5403 usando a fórmula:
| $ n \equiv\displaystyle\frac{ N }{ N_A }$ |
Enquanto no segundo caso, la massa molar ($M_m$) é utilizado com a fórmula:
| $ n = \displaystyle\frac{ M }{ M_m }$ |
ID:(9600, 0)
Relação temperatura x pressão
Descrição 
Em um gás, quando se mantém constante o volume ($V$) e o número de partículas ($N$), observa-se que la pressão ($p$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando la temperatura absoluta ($T$) diminui, la pressão ($p$) também diminui, e vice-versa,
$p \propto T$
como mostrado no seguinte gráfico:

A lei de Gay-Lussac [1] afirma que quando ERROR:5226,0 e o número de partículas ($N$) são mantidos constantes, la pressão ($p$) e la temperatura absoluta ($T$) são diretamente proporcionais.
Isso é expresso com la constante da lei de Gay Lussac ($C_g$) da seguinte forma:
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memória sobre a combinação de substâncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
[1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Memória sobre a combinação de substâncias gasosas entre si), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
ID:(9530, 0)
Relação temperatura x volume
Descrição 
Em um gás, quando la pressão ($p$) e o número de partículas ($N$) são mantidos constantes, observa-se que o volume ($V$) e la temperatura absoluta ($T$) variam de forma proporcional. Quando o volume ($V$) diminui, la temperatura absoluta ($T$) também diminui, e vice-versa,
$V \propto T$
como mostrado no seguinte gráfico:

A lei de Charles [1] afirma que, com la pressão ($p$) e o número de partículas ($N$) constantes, o volume ($V$) e la temperatura absoluta ($T$) são diretamente proporcionais.
Isso pode ser expresso com la constante da lei de Charles ($C_c$) da seguinte forma:
| $\displaystyle\frac{ V }{ T } = C_c$ |
![]() [1] "Sur la dilatação dos gases e vapores" (Sobre a expansão dos gases e vapores), Jacques Charles, Academia Francesa de Ciências (1787)
[1] "Sur la dilatação dos gases e vapores" (Sobre a expansão dos gases e vapores), Jacques Charles, Academia Francesa de Ciências (1787)
ID:(9529, 0)
Relação volume e pressão
Descrição 
Em um gás, se tanto la temperatura absoluta ($T$) quanto o número de partículas ($N$) forem mantidos constantes, observa-se que o volume ($V$) e la pressão ($p$) variam de forma inversamente proporcional. Sempre que o volume ($V$) é reduzido, la pressão ($p$) aumenta, e vice-versa,
$p \propto \displaystyle\frac{1}{V}$
como ilustrado no gráfico a seguir:
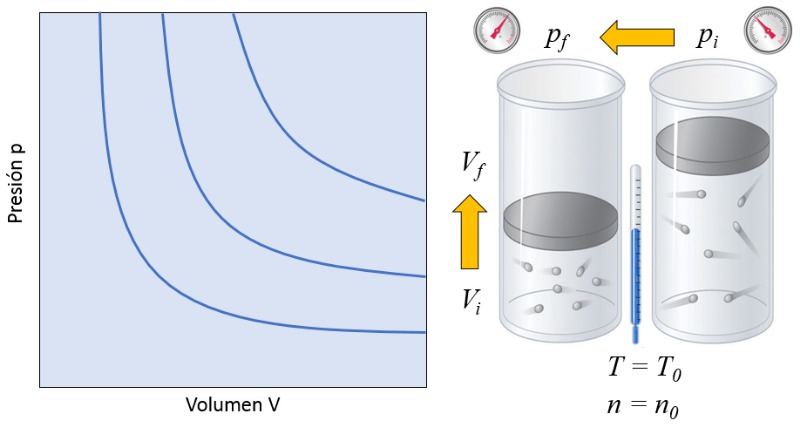
A relação entre o número de partículas ($N$) e la temperatura absoluta ($T$) é que seu produto é igual a uma constante da lei de Boyle ($C_b$), o que corresponde à lei de Boyle [1], em homenagem ao seu descobridor Robert Boyle:
| $ p V = C_b $ |
Às vezes falamos da lei Boyle-Mariotte, lembrando o físico francês Edme Mariotte que descobriu a mesma lei de forma independente em 1676.![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Novos experimentos físico-mecânicos, tocando a mola do ar e seus efeitos), Robert Boyle, Oxford: impresso por H. Hall, Printer to the University, para Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Novos experimentos físico-mecânicos, tocando a mola do ar e seus efeitos), Robert Boyle, Oxford: impresso por H. Hall, Printer to the University, para Tho. Robinson (1660).
ID:(9531, 0)
Moles e razão de volume
Descrição 
Em um gás, quando as constantes la pressão ($p$) e la temperatura absoluta ($T$) são mantidas, observa-se uma relação proporcional entre o volume ($V$) e o número de moles ($n$). Cada vez que o volume ($V$) aumenta, é observado que o número de moles ($n$) também aumenta, e vice-versa,
$n \propto V$
como mostrado no gráfico a seguir:

A Lei de Avogadro [1] afirma que o volume ($V$) e o número de moles ($n$) são diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) são mantidos constantes.
Essa relação pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Ensaio sobre um Método para Determinar as Massas Relativas das Moléculas Elementares dos Corpos e as Proporções nas Quais Elas Entram em Suas Combinações," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Ensaio sobre um Método para Determinar as Massas Relativas das Moléculas Elementares dos Corpos e as Proporções nas Quais Elas Entram em Suas Combinações," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
ID:(9532, 0)
Integrando as leis dos gases
Descrição 
As três leis dos gases que se relacionam com la pressão ($p$), o volume ($V$) e la temperatura absoluta ($T$) são:
• A Lei de Boyle, que estabelece que, à temperatura constante, o produto da pressão e do volume de um gás é constante:
| $ p V = C_b $ |
• A Lei de Charles, que estabelece que, à pressão constante, o volume de um gás é diretamente proporcional à sua temperatura absoluta:
| $\displaystyle\frac{ V }{ T } = C_c$ |
• A Lei de Gay-Lussac, que estabelece que, à volume constante, a pressão de um gás é diretamente proporcional à sua temperatura absoluta:
| $\displaystyle\frac{ p }{ T } = C_g$ |
Essas leis podem ser representadas graficamente, como mostrado na seguinte imagem:

Em 1834, Émile Clapeyron [1] reconheceu que la pressão ($p$), o volume ($V$), la temperatura absoluta ($T$) e o número de moles ($n$) estão relacionados pela lei de Boyle, pela lei de Charles, pela lei de Gay-Lussac e pela lei de Avogadro. Essas leis podem ser expressas de forma mais geral como:
$\displaystyle\frac{pV}{nT} = \text{constante}$
Essa relação geral afirma que o produto da pressão e do volume, dividido pelo número de moles e pela temperatura, permanece constante:
| $ p V = n R_C T $ |
Nessa equação, la constante de gás universal ($R_C$) assume o valor de 8,314 J/K·mol.[1] "Mémoire sur la puissance motrice de la chaleur" (Memória sobre o poder motriz do calor), Émile Clapeyron, Journal de l'École Polytechnique, 1834.
ID:(9525, 0)
