Pression
Concept 
La pression est le résultat des multiples collisions entre les particules de gaz et les parois du récipient. Chaque collision contribue à la pression totale exercée par le gaz. Plus les particules se déplacent rapidement et plus il y a de collisions au cours d'une période de temps donnée, plus la pression sera élevée.
ID:(9599, 0)
Volume
Concept 
Le volume est une propriété fondamentale d'un gaz et peut être compris comme l'espace tridimensionnel occupé par le gaz dans un récipient.
ID:(9601, 0)
Les mols
Concept 
En utilisant le concept de la mole, nous pouvons établir un lien direct entre la quantité de matière d'un gaz et le nombre de particules de le nombre de particules ($N$) présentes en lui. Cela simplifie les calculs et permet d'établir une relation plus intuitive entre la quantité de gaz et ses propriétés caractéristiques, telles que a pression ($p$), le volume ($V$) et a température absolue ($T$).
La constante le numéro d'Avogadro ($N_A$), qui est approximativement égale à $6,02\times 10^{23}$, est une constante fondamentale en chimie et est utilisée pour effectuer des conversions entre l'échelle macroscopique et l'échelle microscopique des atomes et des molécules.
La valeur de ERROR:5394 peut être calculée à partir de le nombre de particules ($N$) et a masse ($M$). Dans le premier cas, elle est obtenue en divisant par ERROR:5403 en utilisant la formule :
Alors que dans le deuxième cas, a masse molaire ($M_m$) est utilisé avec la formule :
ID:(9600, 0)
Relation température/pression
Description 
Dans un gaz, lorsque le volume ($V$) et le nombre de particules ($N$) sont maintenus constants, on observe que a pression ($p$) et a température absolue ($T$) varient de manière proportionnelle. Lorsque a température absolue ($T$) diminue, a pression ($p$) diminue également, et vice versa,
$p \propto T$
comme illustré dans le graphique suivant :

La loi de Gay-Lussac [1] stipule que lorsque le volume ($V$) et le nombre de particules ($N$) sont maintenus constants, a pression ($p$) et a température absolue ($T$) sont directement proportionnels.
Cela s'exprime avec a constante de la loi de Gay Lussac ($C_g$) comme suit :
| $\displaystyle\frac{ p }{ T } = C_g$ |
![]() [1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Mémoire sur la combinaison des substances gazeuses les unes avec les autres), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
[1] "Mémoire sur la combinaison des substances gazeuses les unes avec les autres" (Mémoire sur la combinaison des substances gazeuses les unes avec les autres), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
ID:(9530, 0)
Relation température vs volume
Description 
Dans un gaz, si a pression ($p$) et le nombre de particules ($N$) sont maintenus constants, on observe que le volume ($V$) et a température absolue ($T$) varient de manière proportionnelle. Lorsque le volume ($V$) diminue, a température absolue ($T$) diminue également, et vice versa,
$V \propto T$
comme illustré dans le graphique suivant :

La loi de Charles [1] stipule qu'avec a pression ($p$) et le nombre de particules ($N$) constants, le volume ($V$) et a température absolue ($T$) sont directement proportionnels.
Cela peut être exprimé avec a constante de la loi de Charles ($C_c$) comme suit :
| $\displaystyle\frac{ V }{ T } = C_c$ |
![]() [1] "Sur la dilatation des gaz et des vapeurs", Jacques Charles, Académie des sciences française (1787)
[1] "Sur la dilatation des gaz et des vapeurs", Jacques Charles, Académie des sciences française (1787)
ID:(9529, 0)
Relation volume et pression
Description 
Dans un gaz, si à la fois a température absolue ($T$) et le nombre de particules ($N$) sont maintenus constants, on observe que le volume ($V$) et a pression ($p$) varient de manière inversement proportionnelle. Chaque fois que le volume ($V$) est réduit, a pression ($p$) augmente, et vice versa,
$p \propto \displaystyle\frac{1}{V}$
comme illustré dans le graphique suivant :
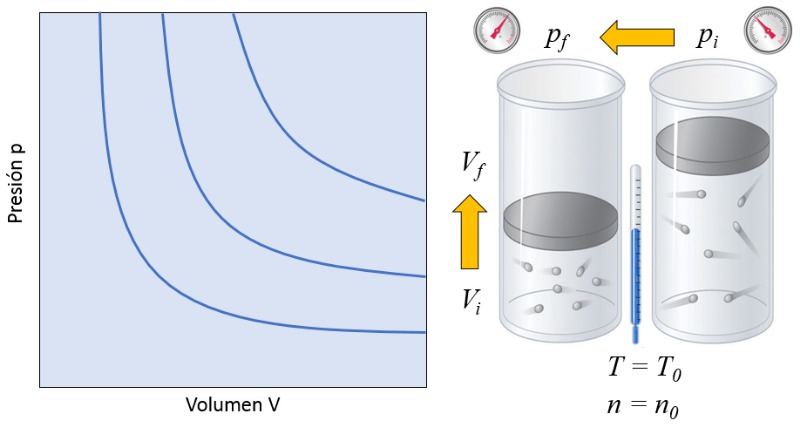
La relation entre le nombre de particules ($N$) et a température absolue ($T$) est que leur produit est égal à Une constante de la loi de Boyle ($C_b$), ce qui correspond à la loi de Boyle [1], en l'honneur de son découvreur Robert Boyle :
| $ p V = C_b $ |
On parle parfois de la loi de Boyle-Mariotte, en souvenir du physicien français Edme Mariotte qui a découvert la même loi de manière indépendante en 1676.![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-mécaniques, concernant la résilience de l'air et ses effets), Robert Boyle, Oxford : imprimé par H. Hall, imprimeur de l'université, pour Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nouveaux essais physico-mécaniques, concernant la résilience de l'air et ses effets), Robert Boyle, Oxford : imprimé par H. Hall, imprimeur de l'université, pour Tho. Robinson (1660).
ID:(9531, 0)
Moles et rapport volumique
Description 
Dans un gaz, lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants, une relation proportionnelle est observée entre le volume ($V$) et le nombre de taupes ($n$). À chaque augmentation de le volume ($V$), on constate également une augmentation correspondante de le nombre de taupes ($n$), et vice versa,
$n \propto V$
comme illustré dans le graphique suivant :

La loi d'Avogadro [1] stipule que le volume ($V$) et le nombre de taupes ($n$) sont directement proportionnels lorsque a pression ($p$) et a température absolue ($T$) sont maintenus constants.
Cette relation peut être exprimée comme suit, en utilisant a constante du principe d'Avogadro ($C_a$) :
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Essai sur une méthode de détermination des masses relatives des molécules élémentaires des corps et des proportions selon lesquelles elles entrent dans ces combinaisons," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Essai sur une méthode de détermination des masses relatives des molécules élémentaires des corps et des proportions selon lesquelles elles entrent dans ces combinaisons," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
ID:(9532, 0)
Intégration des lois des gaz
Description 
Les trois lois des gaz qui sont liées à A pression ($p$), le volume ($V$) et a température absolue ($T$) sont les suivantes :
• La loi de Boyle, qui stipule qu'à température constante, le produit de la pression et du volume d'un gaz est constant :
| $ p V = C_b $ |
• La loi de Charles, qui stipule qu'à pression constante, le volume d'un gaz est directement proportionnel à sa température absolue :
| $\displaystyle\frac{ V }{ T } = C_c$ |
• La loi de Gay-Lussac, qui stipule qu'à volume constant, la pression d'un gaz est directement proportionnelle à sa température absolue :
| $\displaystyle\frac{ p }{ T } = C_g$ |
Ces lois peuvent être représentées graphiquement comme illustré dans l'image suivante :

En 1834, Émile Clapeyron [1] a reconnu que a pression ($p$), le volume ($V$), a température absolue ($T$) et le nombre de taupes ($n$) sont liés par la loi de Boyle, la loi de Charles, la loi de Gay-Lussac et la loi d'Avogadro. Ces lois peuvent être exprimées de manière plus générale comme suit :
$\displaystyle\frac{pV}{nT} = \text{constante}$
Cette relation générale indique que le produit de la pression et du volume divisé par le nombre de moles et la température reste constant :
| $ p V = n R_C T $ |
Dans cette équation, a constante du gaz universel ($R_C$) prend la valeur de 8,314 J/K·mol.[1] "Mémoire sur la puissance motrice de la chaleur", Émile Clapeyron, Journal de l'École Polytechnique, 1834.
ID:(9525, 0)
