Diffusion
Storyboard 
Wenn es Variationen in der Konzentration eines Gases gibt, neigt das Diffusionsphänomen dazu, die Variationen zu verringern. Dies liegt einfach daran, dass ein Molekül eher von einem Bereich mit größerer Konzentration zu einem Bereich mit geringerer Konzentration wechselt als umgekehrt, und zwar einfach aufgrund der Anzahl der vorhandenen Moleküle.
ID:(1311, 0)
Druck
Notiz 
Der Druck entsteht durch die Vielzahl von Kollisionen der Gasteilchen mit den Wänden des Behälters. Jede Kollision trägt zur Gesamtpressung des Gases bei. Je schneller sich die Teilchen bewegen und je mehr Kollisionen innerhalb eines bestimmten Zeitraums auftreten, desto höher ist der Druck.
ID:(9599, 0)
Volumen
Zitat 
Das Volumen ist eine grundlegende Eigenschaft eines Gases und kann als der dreidimensionale Raum verstanden werden, den das Gas in einem Behälter einnimmt.
ID:(9601, 0)
Die Mole
Übung 
Durch die Verwendung des Konzepts des Mols können wir die Menge einer Substanz in einem Gas direkt mit der Anzahl der darin enthaltenen Teilchen von der Anzahl der Partikel ($N$) in Beziehung setzen. Dies erleichtert Berechnungen und ermöglicht eine intuitivere Verbindung zwischen der Menge des Gases und seinen definierenden Eigenschaften wie die Druck ($p$), der Volumen ($V$) und die Absolute Temperatur ($T$).
Die Konstante der Avogadros Nummer ($N_A$), die ungefähr $6,02\times 10^{23}$ entspricht, ist eine grundlegende Konstante in der Chemie und wird verwendet, um zwischen der makroskopischen und mikroskopischen Skala von Atomen und Molekülen zu konvertieren.
Der Wert von der Número de Moles ($n$) kann aus der Anzahl der Partikel ($N$) und die Masse ($M$) berechnet werden. Im ersten Fall wird er durch ERROR:5403 geteilt, was mit der Formel erreicht wird:
Während im zweiten Fall die Molmasse ($M_m$) mit der Formel verwendet wird:
ID:(9600, 0)
Beziehung zwischen Temperatur und Druck
Gleichung 
In einem Gas, wenn der Volumen ($V$) und der Anzahl der Partikel ($N$) konstant gehalten werden, beobachtet man, dass die Druck ($p$) und die Absolute Temperatur ($T$) proportional variieren. Wenn die Absolute Temperatur ($T$) abnimmt, verringert sich auch die Druck ($p$), und umgekehrt,
$p \propto T$
wie im folgenden Diagramm dargestellt:

Das Gesetz von Gay-Lussac [1] besagt, dass bei konstantem der Volumen ($V$) und der Anzahl der Partikel ($N$) Die Druck ($p$) und die Absolute Temperatur ($T$) direkt proportional sind.
Dies wird mit die Gesetzkonstante von Gay Lussac ($C_g$) wie folgt ausgedrückt:
![]() [1] "Memoir on the Combination of Gaseous Substances with Each Other" (Abhandlung über die Kombination von gasförmigen Substanzen miteinander), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
[1] "Memoir on the Combination of Gaseous Substances with Each Other" (Abhandlung über die Kombination von gasförmigen Substanzen miteinander), Joseph Louis Gay-Lussac, Annales scientifiques de l'É.N.S. 3e série, tome 3 (1886)
ID:(9530, 0)
Beziehung zwischen Temperatur und Volumen
Script 
In einem Gas, wenn die Druck ($p$) und der Anzahl der Partikel ($N$) konstant gehalten werden, beobachtet man, dass der Volumen ($V$) und die Absolute Temperatur ($T$) proportional zueinander variieren. Wenn der Volumen ($V$) abnimmt, nimmt auch die Absolute Temperatur ($T$) ab, und umgekehrt,
$V \propto T$
wie in der folgenden Grafik dargestellt:

Das Gesetz von Charles [1] besagt, dass bei konstantem die Druck ($p$) und der Anzahl der Partikel ($N$) Der Volumen ($V$) und die Absolute Temperatur ($T$) direkt proportional sind.
Dies kann mit die Charles-Gesetz-Konstante ($C_c$) wie folgt ausgedrückt werden:
![]() [1] "Sur la dilatación de los gases y vapores" (Über die Ausdehnung von Gasen und Dämpfen), Jacques Charles, Französische Akademie der Wissenschaften (1787)
[1] "Sur la dilatación de los gases y vapores" (Über die Ausdehnung von Gasen und Dämpfen), Jacques Charles, Französische Akademie der Wissenschaften (1787)
ID:(9529, 0)
Beziehung zwischen Volumen und Druck
Variable 
In einem Gas, wenn sowohl die Absolute Temperatur ($T$) als auch der Anzahl der Partikel ($N$) konstant gehalten werden, beobachtet man, dass der Volumen ($V$) und die Druck ($p$) sich invers proportional verhalten. Immer wenn der Volumen ($V$) reduziert wird, erhöht sich die Druck ($p$) und umgekehrt,
$p \propto \displaystyle\frac{1}{V}$
wie in der folgenden Grafik dargestellt:
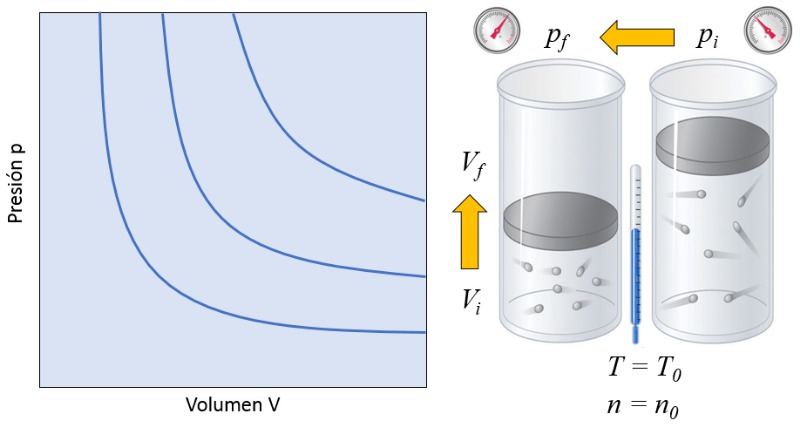
Die Beziehung zwischen der Anzahl der Partikel ($N$) und die Absolute Temperatur ($T$) ist, dass ihr Produkt gleich eine Boyles Gesetzeskonstante ($C_b$) ist, was dem Boyle'schen Gesetz [1] entspricht, benannt nach seinem Entdecker Robert Boyle:
Manchmal sprechen wir über das Boyle-Mariotte-Gesetz und erinnern uns an den französischen Physiker Edme Mariotte, der das gleiche Gesetz 1676 unabhängig voneinander entdeckte.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Neue physikalisch-mechanische Experimente, die den Federmechanismus der Luft und seine Auswirkungen betreffen), Robert Boyle, Oxford: gedruckt von H. Hall, Drucker der Universität, für Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Neue physikalisch-mechanische Experimente, die den Federmechanismus der Luft und seine Auswirkungen betreffen), Robert Boyle, Oxford: gedruckt von H. Hall, Drucker der Universität, für Tho. Robinson (1660).
ID:(9531, 0)
Mol- und Volumenverhältnis
Audio 
In einem Gas, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden, wird eine proportionale Beziehung zwischen der Volumen ($V$) und der Anzahl der Mol ($n$) beobachtet. Jedes Mal, wenn der Volumen ($V$) zunimmt, wird festgestellt, dass auch der Anzahl der Mol ($n$) zunimmt, und umgekehrt,
$n \propto V$
wie im folgenden Diagramm dargestellt:

Das Avogadrosche Gesetz [1] besagt, dass der Volumen ($V$) und der Anzahl der Mol ($n$) direkt proportional sind, wenn die Druck ($p$) und die Absolute Temperatur ($T$) konstant gehalten werden.
Diese Beziehung kann wie folgt ausgedrückt werden, unter Verwendung von die Konstante des Avogadro-Prinzips ($C_a$):
![]() [1] "Versuch über eine Methode, die relativen Massen der Elementarmoleküle der Körper zu bestimmen und die Verhältnisse, in denen sie sich in diesen Verbindungen befinden" (Essay über eine Methode zur Bestimmung der relativen Massen der elementaren Moleküle von Körpern und der Verhältnisse, in denen sie sich in diesen Verbindungen befinden), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Versuch über eine Methode, die relativen Massen der Elementarmoleküle der Körper zu bestimmen und die Verhältnisse, in denen sie sich in diesen Verbindungen befinden" (Essay über eine Methode zur Bestimmung der relativen Massen der elementaren Moleküle von Körpern und der Verhältnisse, in denen sie sich in diesen Verbindungen befinden), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
ID:(9532, 0)
Integration der Gasgesetze
Video 
Die drei Gasgesetze, die mit die Druck ($p$), der Volumen ($V$) und die Absolute Temperatur ($T$) in Beziehung stehen, sind:
• Das Gesetz von Boyle, das besagt, dass bei konstanter Temperatur das Produkt aus Druck und Volumen eines Gases konstant ist:
• Das Gesetz von Charles, das besagt, dass bei konstantem Druck das Volumen eines Gases direkt proportional zur absoluten Temperatur ist:
• Das Gesetz von Gay-Lussac, das besagt, dass bei konstantem Volumen der Druck eines Gases direkt proportional zur absoluten Temperatur ist:
Diese Gesetze können graphisch wie in der folgenden Abbildung dargestellt werden:

Im Jahr 1834 erkannte Émile Clapeyron [1], dass die Druck ($p$), der Volumen ($V$), die Absolute Temperatur ($T$) und der Anzahl der Mol ($n$) durch das Boyle'sche Gesetz, das Charles'sche Gesetz, das Gesetz von Gay-Lussac und das Avogadro-Gesetz miteinander verbunden sind. Diese Gesetze können allgemeiner ausgedrückt werden als:
$\displaystyle\frac{pV}{nT} = \text{konstant}$
Diese allgemeine Beziehung besagt, dass das Produkt von Druck und Volumen, geteilt durch die Anzahl der Mole und die Temperatur, konstant bleibt:
In dieser Gleichung nimmt die Universelle Gas Konstante ($R_C$) den Wert von 8,314 J/K·mol an.
[1] "Mémoire sur la puissance motrice de la chaleur" (Abhandlung über die treibende Kraft der Wärme), Émile Clapeyron, Journal de l'École Polytechnique, 1834.
ID:(9525, 0)
