Ley de Boyle-Mariotte
Storyboard 
La ley de Boyle-Mariotte establece que el producto de la presión ($p$) y el volumen ($V$) de un gas se mantiene constante cuando la temperatura absoluta y la cantidad de moles no varían.
Esto significa que la presión ($p$) varía inversamente proporcional a el volumen ($V$).
ID:(1472, 0)
Ley de Boyle-Mariotte
Storyboard 
La ley de Boyle-Mariotte establece que el producto de 5224 y 5226 de un gas se mantiene constante cuando la temperatura absoluta y la cantidad de moles no varían. Esto significa que 5224 varía inversamente proporcional a 5226.
Variables
Cálculos
Cálculos
Ecuaciones
La ley de Boyle establece que, con la temperatura absoluta ($T$) constante, se cumple que el producto de la presión ($p$) y el volumen ($V$) es igual a la constante de la ley de Boyle ($C_b$):
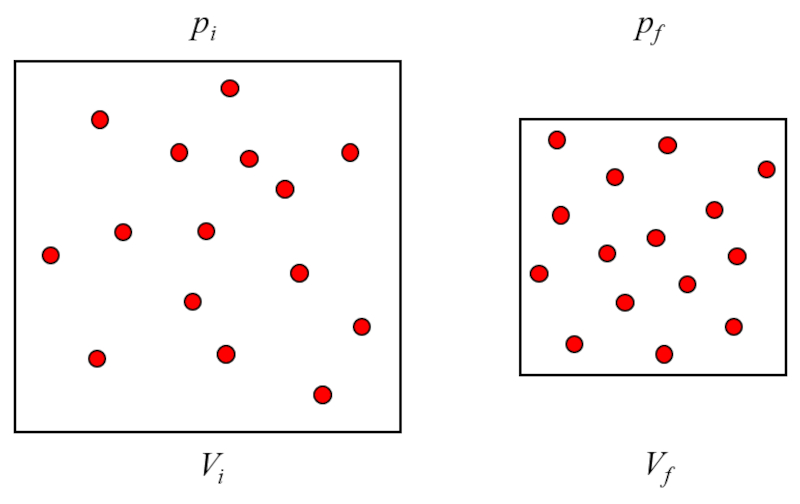
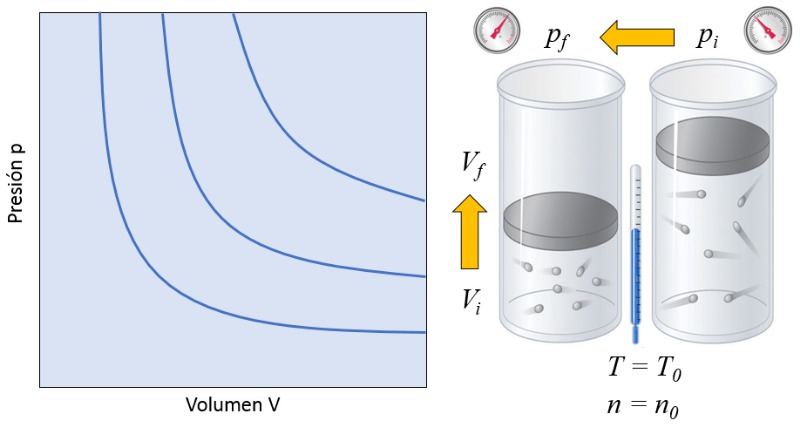
Esto significa que si un gas pasa de un estado inicial (la presión en estado inicial ($p_i$) y el volumen en estado i ($V_i$)) a un estado final (la presión en estado final ($p_f$) y el volumen en estado f ($V_f$)), manteniendo la temperatura absoluta ($T$) constante, debe siempre cumplir la ley de Boyle:
$p_i V_i = C_b = p_f V_f$
Por lo tanto, se tiene que:
Si en un cambio isot rmico en el que no var a el contenido se cumple que la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), el volumen en estado i ($V_i$), y el volumen en estado f ($V_f$) est n relacionados por:
Entonces, se puede introducir la densidad ($\rho$), que con la masa ($M$) y el volumen ($V$) cumple:
Lo que nos lleva a la densidad en estado i ($\rho_i$) y la densidad en estado f ($\rho_f$) como:
Ejemplos
La ley de Boyle-Mariotte, tambi n conocida simplemente como la ley de Boyle, describe la relaci n inversa entre la presi n y el volumen de un gas a temperatura constante. Establece que para una cantidad fija de gas, cuando la temperatura se mantiene constante, la presi n del gas aumenta a medida que el volumen disminuye, y viceversa. Esto significa que si comprimes un gas reduciendo su volumen, su presi n aumentar proporcionalmente, y si expandes el volumen, la presi n disminuir proporcionalmente. Esta relaci n es fundamental para entender el comportamiento de los gases y se expresa matem ticamente por el producto de la presi n y el volumen siendo una constante para una cantidad de gas dada a temperatura constante.
La presión ($p$) se genera al chocar las part culas del gas con la superficie del contenedor del gas. Al ser la temperatura absoluta ($T$) constante, la energ a de las part culas no var an y los golpes de estas con las superficies del contenedor del gas no variar n en el impulso transferido. Sin embargo, el n mero de impactos depende del n mero de part culas pr ximas a la superficie que, a su vez, es proporcional a la concentración de particulas ($c_n$) del gas.
Por otro lado, la densidad es inversamente proporcional a el volumen ($V$), lo que nos lleva a la siguiente relaci n:
$p \propto c_n \propto \displaystyle\frac{1}{V}$
En un gas, si se mantienen la temperatura absoluta ($T$) y el número de partículas ($N$) constantes, se observa que el volumen ($V$) y la presión ($p$) var an de forma inversamente proporcional. Cada vez que se reduce el volumen ($V$), se observa que la presión ($p$) aumenta y viceversa,
$p \propto \displaystyle\frac{1}{V}$
como se ilustra en el siguiente gr fico:
La relaci n entre el número de partículas ($N$) y la temperatura absoluta ($T$) es que su producto es igual a una constante de la ley de Boyle ($C_b$), lo que corresponde a la ley de Boyle [1], en honor a su descubridor Robert Boyle:
Algunas veces se habla de la ley Boyle-Mariotte recordando al f sico frances Edme Mariotte que descubrio en 1676 la misma ley en forma independiente.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nuevos experimentos f sico-mec nicos, tocando el resorte del aire y sus efectos), Robert Boyle, Oxford: printed by H. Hall, Printer to the University, for Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Nuevos experimentos f sico-mec nicos, tocando el resorte del aire y sus efectos), Robert Boyle, Oxford: printed by H. Hall, Printer to the University, for Tho. Robinson (1660).
Robert Boyle fue un cient fico irland s nacido en 1627. Es considerado uno de los fundadores de la qu mica moderna y es conocido por sus contribuciones en el campo del comportamiento de los gases. La relaci n entre Robert Boyle y la Ley de Boyle se debe a que l formul dicha ley en el siglo XVII. La Ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presi n. Boyle realiz experimentos que demostraron esta relaci n y sentaron las bases para comprender el comportamiento de los gases.
La ley de Boyle establece que, con la temperatura absoluta ($T$) constante, se cumple que el producto de la presión ($p$) y el volumen ($V$) es igual a la constante de la ley de Boyle ($C_b$):
Esto significa que si un gas pasa de un estado inicial (la presión en estado inicial ($p_i$) y el volumen en estado i ($V_i$)) a un estado final (la presión en estado final ($p_f$) y el volumen en estado f ($V_f$)), manteniendo la temperatura absoluta ($T$) constante, debe siempre cumplir la ley de Boyle:
$p_i V_i = C_b = p_f V_f$
Por lo tanto, se tiene que:
Si en un cambio isot rmico en el que no var a el contenido se cumple que la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), el volumen en estado i ($V_i$), y el volumen en estado f ($V_f$) est n relacionados por:
Entonces, se puede introducir la densidad ($\rho$), que con la masa ($M$) y el volumen ($V$) cumple:
Lo que nos lleva a la densidad en estado i ($\rho_i$) y la densidad en estado f ($\rho_f$) como:
La ley de Boyle establece una relaci n entre el volumen ($V$) y la presión ($p$), indicando que su producto es igual a la constante de la ley de Boyle ($C_b$), de la siguiente manera:
La ley de Boyle establece una relaci n entre el volumen ($V$) y la presión ($p$), indicando que su producto es igual a la constante de la ley de Boyle ($C_b$), de la siguiente manera:
Si un gas pasa de un estado inicial (i) a un estado final (f) con la temperatura absoluta ($T$) constante, se cumple que para la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$):
La ley de Boyle para los estados inicial (la densidad en estado i ($\rho_i$), la presión en estado inicial ($p_i$)) y final (la densidad en estado f ($\rho_f$) , la presión en estado final ($p_f$)) se obtiene:
ID:(1472, 0)