Principio de Avogadro
Storyboard 
El principio de Avogadro establece que la división de el número de moles ($n$) por el volumen ($V$) es constante, siempre que la presión ($p$) y la temperatura absoluta ($T$) sean constantes.
Esto implica que el número de moles ($n$) varía de manera proporcional a el volumen ($V$).
ID:(1475, 0)
Principio de Avogadro
Storyboard 
El principio de Avogadro establece que la división de 9339 por 5226 es constante, siempre que 5224 y 5177 sean constantes. Esto implica que 9339 varía de manera proporcional a 5226.
Variables
Cálculos
Cálculos
Ecuaciones
El principio de Avogadro establece que cuando la presión ($p$) y la temperatura absoluta ($T$) se mantienen constantes, la proporci n de ERROR:6679 a el volumen ($V$) es igual a la constante del principio de Avogadro ($C_a$):
Esto significa que si un gas pasa de un estado inicial (el número de moles en estado i ($n_i$) y el volumen en estado i ($V_i$)) a un estado final (el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$)) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Por lo tanto, se tiene:
Ejemplos
El principio de Avogadro establece que vol menes iguales de gases, a la misma temperatura y presi n, contienen el mismo n mero de mol culas. Esto significa que el volumen de un gas es directamente proporcional al n mero de mol culas (o moles) presentes cuando la temperatura y la presi n se mantienen constantes. El principio es fundamental para entender el comportamiento de los gases y forma la base de la ley de los gases ideales. Permite determinar la cantidad de gas en un volumen dado y es esencial para c lculos que involucran reacciones qu micas y mezclas de gases.
Existen variables intensivas y extensivas. Las primeras son caracter sticas del estado del sistema y no dependen de su tama o. Dos ejemplos son la presión ($p$) y la temperatura absoluta ($T$). Si deseamos un sistema m s grande en el mismo estado, tanto la presión ($p$) como la temperatura absoluta ($T$) deben permanecer iguales.
La situaci n es diferente con el volumen ($V$), que es una variable extensiva, lo que significa que si se necesita un sistema m s grande, esta variable tendr que aumentar en la proporci n correspondiente. Lo mismo ocurre con el número total de moles ($n$):
Adem s, ambas variables deben aumentar en la misma proporci n, por lo que, si la presión ($p$) y la temperatura absoluta ($T$) son constantes, ser n proporcionales entre s :
$n \propto V$
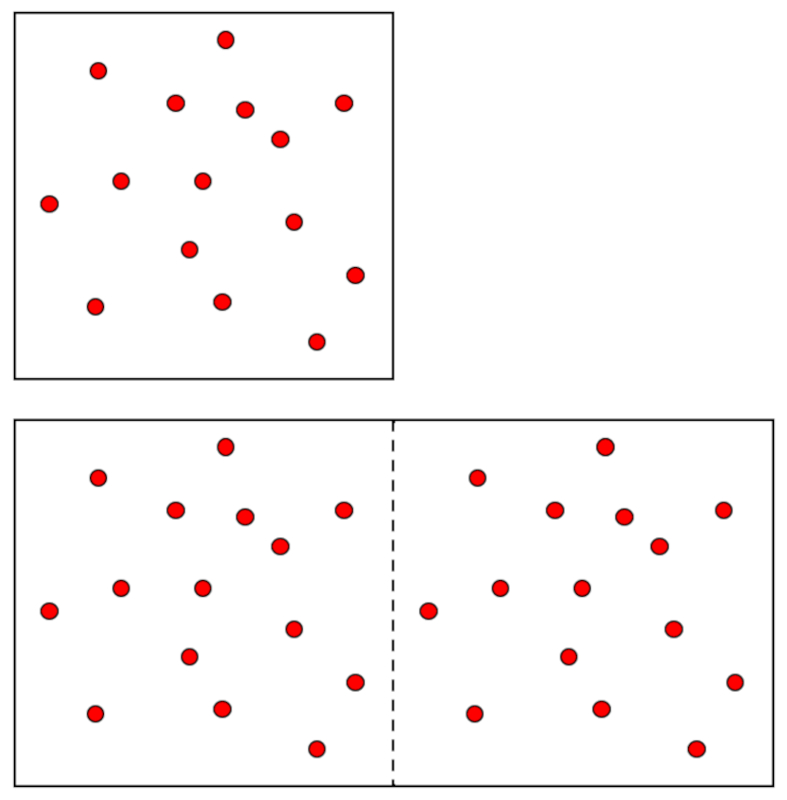
En un gas, cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$), se observa una variaci n proporcional entre el volumen ($V$) y el número de moles ($n$). Cada vez que el volumen ($V$) aumenta, se nota un aumento correspondiente en el número de moles ($n$), y viceversa,
$n \propto V$
como se ilustra en el siguiente gr fico:
La Ley de Avogadro [1] establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
![]() [1] "Essai d'une mani re de d terminer les masses relatives des mol cules l mentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un m todo para determinar las masas relativas de las mol culas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
[1] "Essai d'une mani re de d terminer les masses relatives des mol cules l mentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons" (Ensayo sobre un m todo para determinar las masas relativas de las mol culas elementales de las sustancias y las proporciones en las que intervienen en sus combinaciones), Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811)
Amadeo Avogadro, cuyo nombre completo es Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, fue un cient fico italiano nacido el 9 de agosto de 1776 y fallecido el 9 de julio de 1856. Avogadro es conocido principalmente por sus contribuciones al desarrollo de la teor a molecular y la formulaci n de la ley de Avogadro. l propuso que vol menes iguales de gases, a la misma temperatura y presi n, contienen un n mero igual de part culas, lo que ahora se conoce como el principio de Avogadro o la ley de Avogadro. Este concepto fue fundamental en el desarrollo del concepto de mol y proporcion una base para entender las relaciones entre la cantidad de sustancia, el volumen y el n mero de part culas en los gases. A pesar de sus importantes contribuciones, el trabajo de Avogadro no fue ampliamente reconocido durante su vida, y sus ideas fueron aceptadas a os despu s de su muerte. Hoy en d a, Avogadro es honrado por sus contribuciones fundamentales a la qu mica y es considerado uno de los pioneros de la teor a molecular moderna.
El principio de Avogadro establece que cuando la presión ($p$) y la temperatura absoluta ($T$) se mantienen constantes, la proporci n de ERROR:6679 a el volumen ($V$) es igual a la constante del principio de Avogadro ($C_a$):
Esto significa que si un gas pasa de un estado inicial (el número de moles en estado i ($n_i$) y el volumen en estado i ($V_i$)) a un estado final (el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$)) manteniendo la presión ($p$) y la temperatura absoluta ($T$) constantes, la ley de Gay-Lussac siempre debe cumplirse:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Por lo tanto, se tiene:
La Ley de Avogadro establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
La Ley de Avogadro establece que el volumen ($V$) y el número de moles ($n$) son directamente proporcionales cuando se mantienen constantes la presión ($p$) y la temperatura absoluta ($T$).
Esta relaci n se puede expresar de la siguiente manera, utilizando la constante del principio de Avogadro ($C_a$):
Si un gas pasa de un estado inicial (i) a un estado final (f) manteniendo constantes la presión ($p$) y la temperatura absoluta ($T$), entonces para el número de moles en estado i ($n_i$), el volumen en estado i ($V_i$), el número de moles en estado f ($n_f$) y el volumen en estado f ($V_f$) se cumple:
ID:(1475, 0)