Relaciones adiabáticas
Storyboard 
Las relaciones adiabáticas describen cómo cambian las propiedades de un gas durante un proceso adiabático, en el cual no se intercambia calor con el entorno. Para un gas ideal, la presión y el volumen están relacionados de tal manera que su producto, elevado a la potencia del índice adiabático, permanece constante. De manera similar, la relación entre la temperatura y el volumen sigue que la temperatura, multiplicada por el volumen elevado a uno menos el índice adiabático, es constante. La relación entre temperatura y presión también sigue un patrón similar, indicando que los cambios de temperatura y presión están vinculados de manera predecible durante los procesos adiabáticos.
ID:(1481, 0)
Proceso adiábatico
Imagen 
Cuando un gas se expande rápidamente, las moléculas de vapor de agua no tienen tiempo suficiente para intercambiar energía con el entorno, por lo que no se transfere calor, es decir, la variación de calor ($\delta Q$) se mantiene constante:
$\delta Q = 0$
Los procesos que se realizan bajo esta condición se denominan procesos adiabaticos [1,2].
La expansión del gas requiere que el sistema realice trabajo o genere el diferencial inexacto del trabajo ($\delta W$). Sin embargo, la energía necesaria para esto no puede provenir de la energía interna ($U$), por lo que se debe obtener del calor. Como resultado, la temperatura del sistema disminuye, lo que se refleja en una reducción de la variación de calor ($\delta Q$).
Un ejemplo típico de este proceso es la formación de nubes. Cuando el aire asciende por convección, se expande y realiza trabajo, lo que provoca un enfriamiento. La humedad presente en el aire se condensa, formando nubes.
Por otro lado, cuando se realiza trabajo sobre el sistema, se realiza un trabajo positivo el diferencial inexacto del trabajo ($\delta W$), pero como la energía interna ($U$) no puede aumentar, la energía térmica en la variación de calor ($\delta Q$) aumenta, lo que significa un aumento en la temperatura del sistema.
Un ejemplo común de este proceso es el funcionamiento de una bomba. Si intentamos inflar algo rápidamente, realizamos trabajo sobre el sistema de manera adiabática, lo que resulta en un aumento de la variación de calor ($\delta Q$) y, por lo tanto, en un aumento de la temperatura del sistema.
![]() [1] "Réflexions sur la puissance motrice du feu" (Reflexiones sobre la fuerza motriz del fuego), Sadi Carnot, 1824
[1] "Réflexions sur la puissance motrice du feu" (Reflexiones sobre la fuerza motriz del fuego), Sadi Carnot, 1824
![]() [2] "Über die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen" (Sobre la fuerza móvil del calor y las leyes que de ella se pueden derivar para la teoría del calor misma), Rudolf Clausius, Annalen der Physik und Chemie, 1850
[2] "Über die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen" (Sobre la fuerza móvil del calor y las leyes que de ella se pueden derivar para la teoría del calor misma), Rudolf Clausius, Annalen der Physik und Chemie, 1850
ID:(41, 0)
Relación caso adiabático de temperatura y volumen
Nota 
En el caso adiabático, para ERROR:5177,0 y el volumen ($V$) con la constante universal de los gases ($R_C$), la masa molar ($M_m$), el calor específico de gases a volumen constante ($c_V$), la variación de la temperatura ($dT$) y la variación del volumen ($\Delta V$), se tiene la siguiente ecuación:
Al introducir el indice adiabático ($\kappa$), esta ecuación se puede expresar como:
Lo que nos permite escribir la ecuación como:
$\displaystyle\frac{dT}{T}=-(\kappa - 1)\displaystyle\frac{dV}{V}$
Si integramos esta expresión entre el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$), así como entre la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$), obtenemos:
ID:(15741, 0)
Relación caso adiabático de presión y volumen
Cita 
Con los valores el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$) y el indice adiabático ($\kappa$), se presenta la siguiente relación:
Utilizando la ecuación de los gases con los parámetros la presión ($p$), el volumen ($V$), el número de moles ($n$), la constante universal de los gases ($R_C$) y la temperatura absoluta ($T$), obtenemos la siguiente expresión:
Esta ecuación describe cómo, en un proceso adiabático que varía desde una situación inicial hasta una final en términos de la presión ($p$) y el volumen ($V$), se relaciona con la presión en estado inicial ($p_i$) y la presión en estado final ($p_f$) de la siguiente manera:
ID:(15742, 0)
Relación caso adiabático de temperatura y presión
Ejercicio 
Con los valores de el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$), y el indice adiabático ($\kappa$), se establece la siguiente relación:
Al emplear la ecuación de los gases con los parámetros la presión ($p$), el volumen ($V$), el número de moles ($n$), la constante universal de los gases ($R_C$) y la temperatura absoluta ($T$), obtenemos la siguiente expresión:
Esta ecuación describe cómo, en un proceso adiabático que varía desde una situación inicial hasta una final en términos de la presión ($p$) y la temperatura absoluta ($T$), se relaciona con la presión en estado inicial ($p_i$) y la presión en estado final ($p_f$) de la siguiente manera:
.
ID:(15743, 0)
Comparación diagrama VT isobárico y adiabático
Ecuación 
Cuando comparamos la relación entre la temperatura absoluta ($T$) y el volumen ($V$) en el caso isotérmico (donde "iso" significa igual y "barico" se refiere a la presión), obtenemos la siguiente ecuación para la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$), el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$):
En el caso adiabático, esta ecuación debe satisfacerse con el indice adiabático ($\kappa$), lo que nos lleva a la siguiente ecuación:
Si consideramos $\kappa=1,4$, esto se puede observar gráficamente en la siguiente representación:

La gran diferencia en el comportamiento de un gas en un proceso isobárico en comparación con un proceso adiabático es que, en el primer caso, si un sistema se expande, la temperatura aumenta, mientras que en el segundo caso, disminuye.
ID:(11172, 0)
Formación de nubes por expansión adiabática
Script 
Si se coloca agua en una botella y se bombea aire para aumentar la presión, se obtiene aire con alta humedad a presión elevada. Si se abre la botella al exterior, el aire se expande, lo que provoca una reducción de la temperatura y lleva al aire a su punto de saturación, dando lugar a la formación de vapor de agua y la aparición de una nube.
Cloud in a Bottle - Sick Science! #076 (https://www.youtube.com/watch?v=LHjDT9pYxRA)
ID:(11222, 0)
Comparación diagrama pV isotérmico y adiabático
Variable 
Cuando comparamos la relación entre la presión ($p$) y el volumen ($V$) en el caso isotérmico (iso = igual y térmico = temperatura), tenemos para la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), el volumen en estado i ($V_i$) y el volumen en estado f ($V_f$) la siguiente ecuación:
En el caso adiabático, esta ecuación debe satisfacerse con el indice adiabático ($\kappa$), lo que nos lleva a la siguiente ecuación:
Si consideramos $\kappa=1.4$, esto se puede observar de manera gráfica en la siguiente representación:
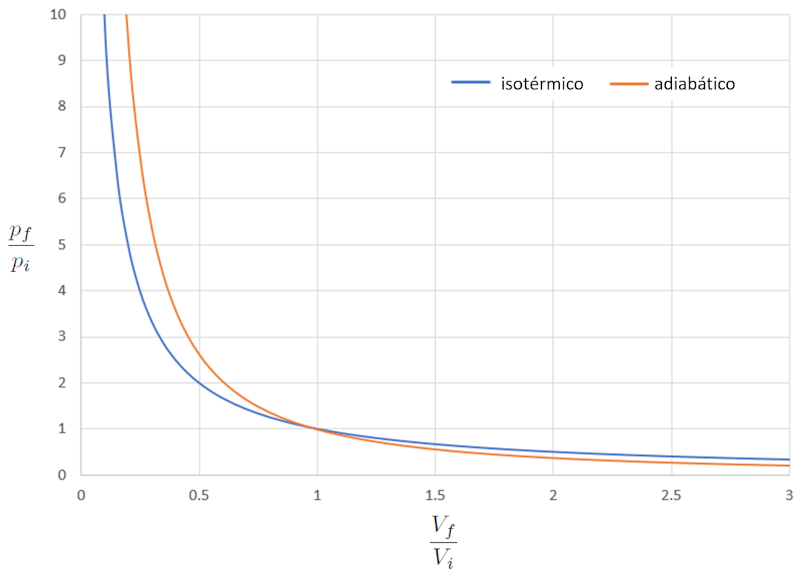
En otras palabras, en un proceso de compresión, si el proceso es isotérmico, la respuesta es más suave en comparación con el caso adiabático, ya que la presión aumenta más lentamente. En un proceso de expansión, el comportamiento del gas en modo adiabático es más suave.
ID:(11170, 0)
Romper un objeto con compresión adiabática
Audio 
Cuando se golpea la parte superior de una botella, la botella se desplaza mientras que el líquido, debido a la inercia, tiende a quedarse atrás. Esto crea un vacío en el fondo de la botella, lo que provoca que el líquido se acelere y eventualmente golpee el fondo de la botella, causando su ruptura. Este fenómeno se conoce como el "martillo de agua" (water hammer). La reacción adiabática del material, debido al corto tiempo del impacto, lo hace más rígido, lo que contribuye a este efecto.
Sin embargo, en el caso de una bebida gaseosa, el líquido tiende a ceder en las burbujas de gas. Estas burbujas permiten que el líquido se contraiga en lugar de golpear el fondo de la botella, lo que evita su ruptura. En cambio, el líquido es expulsado a través de las burbujas generadas.
Extraído de WATER HAMMER (18,000FPS) | Why Does SODA Not Break the Bottle? (https://www.youtube.com/watch?v=tlRikG7FOdw)
ID:(11223, 0)
Comparación diagrama pT isocórico y adiabático
Video 
Cuando comparamos la relación entre la temperatura absoluta ($T$) y la presión ($p$) en el caso isocórico (donde "iso" significa igual y "córico" se refiere al volumen), obtenemos la siguiente ecuación para la presión en estado inicial ($p_i$), la presión en estado final ($p_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$):
En el caso adiabático, esta ecuación debe cumplirse con el indice adiabático ($\kappa$), lo que nos conduce a la siguiente expresión:
Si consideramos $\kappa=1.4$, esto se puede observar de forma gráfica en la siguiente representación:
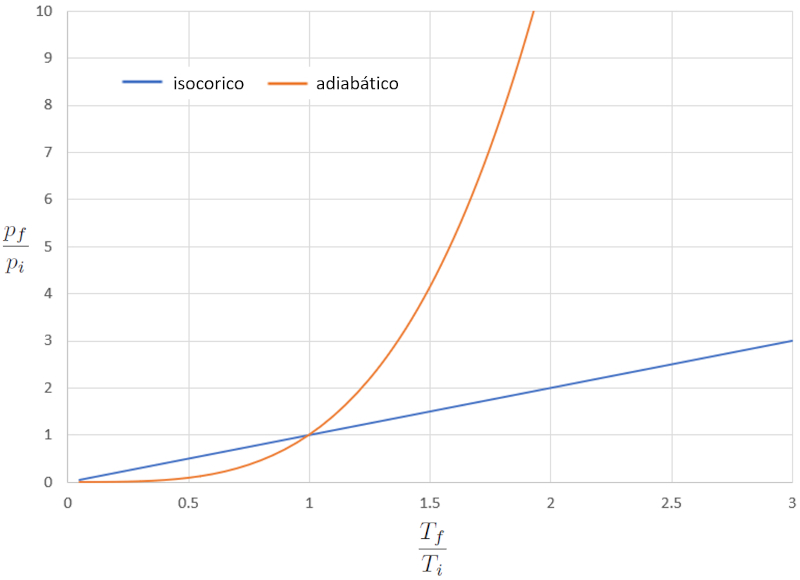
En este caso, la diferencia más significativa se presenta a temperaturas elevadas, donde la presión aumenta de forma drástica. En otras palabras, si aumentamos drásticamente la presión en el caso adiabático, la temperatura variará solo ligeramente, mientras que en el caso normal, la variación será más pronunciada.
ID:(11171, 0)
Incinerar un objeto con compresión adiabática
Unidad 
Si se coloca un objeto en un contenedor de aire al que se le puede aumentar la presión de manera dramática, al realizar una compresión adiabática, se puede elevar la temperatura hasta el punto en que el material se incinera de forma espontánea.
Fire Syringe Demo (https://www.youtube.com/watch?v=OEwlwYqPIAw)
ID:(11221, 0)
