Difusión del Vapor de Agua en el Suelo
Storyboard 
Cuando la concentración no es uniforme se inician procesos de difusión con el que el vapor de agua se desplaza de zonas de mayor a menor concentración.
ID:(376, 0)
Camino libre en un gas
Concepto 
Cuando una partícula de un gas se desplaza, interactúa con las demás partículas en su entorno. La forma más simple de esta interacción es a través de choques elásticos, lo que significa que la partícula choca sin perder energía, cambiando su dirección para luego impactar con otra partícula.
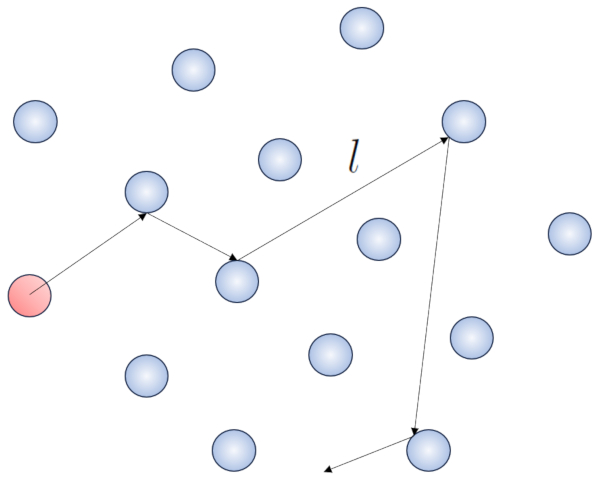
Dentro de este proceso, tiene sentido definir el camino libre (\bar{l}), cuyo valor dependerá de una concentración de particulas (c_n).
ID:(1708, 0)
Camino libre sin movimiento de vecinos
Concepto 
Cuando una partícula de un radio dado se desplaza en el espacio, efectivamente ocupa el espacio de un cilindro con el mismo radio. Para que esta partícula colisione con otra, esta segunda debe tener parte de su volumen dentro de dicho cilindro. En el caso más extremo, la segunda partícula se encuentra a una distancia de dos radios del primero, de manera que el borde del cilindro está en contacto con un punto de la esfera más cercano al eje del cilindro. El centro de esta esfera se encuentra a una distancia igual a un radio desde la superficie del cilindro:
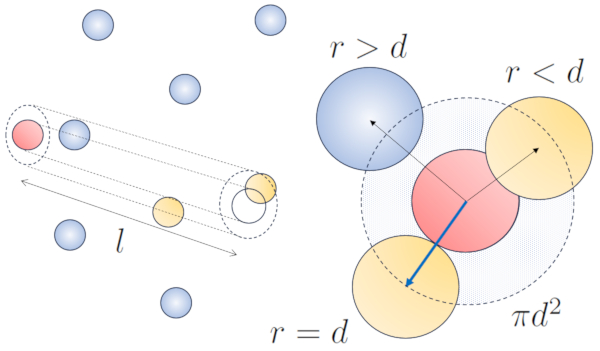
Por lo tanto, la distancia entre el eje del cilindro y el centro de cualquier partícula es de dos radios, es decir, un diámetro. En otras palabras, se puede concebir que el volumen ocupado de manera literal por la partícula que se desplaza en el espacio es un cilindro con una longitud igual al camino libre y un radio igual al diámetro de la propia partícula.
ID:(1962, 0)
Camino libre con movimiento de vecinos
Concepto 
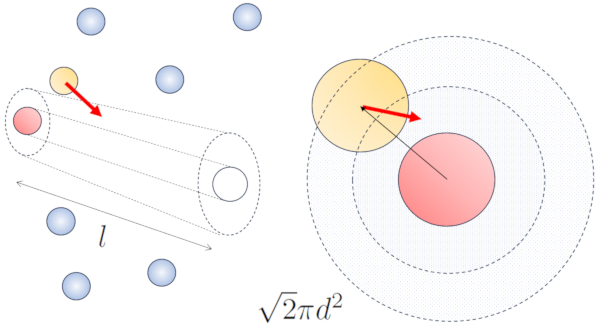
Cuando las partículas vecinas están en movimiento, existe una mayor probabilidad de colisión debido a que durante el mismo intervalo de tiempo, recorren una mayor distancia. Las componentes de velocidad, v_x, v_y, y v_z, fluctúan alrededor de valores medios \sqrt{\langle v_x^2\rangle}, \sqrt{\langle v_y^2\rangle} y \sqrt{\langle v_z^2\rangle}. Si asumimos que el sistema es isotrópico, el promedio de cada componente será igual a \displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}. Por lo tanto, en el eje a lo largo del cual se desplaza la partícula, recorrerá una distancia
\sqrt{\langle v_z^2\rangle}dt=\displaystyle\frac{1}{3}\sqrt{\langle v^2\rangle}dt
Al mismo tiempo, las partículas que se desplazan perpendicularmente habrán recorrido una distancia:
\sqrt{\langle v_x^2\rangle+\langle v_y^2\rangle}dt=\displaystyle\frac{\sqrt{2}}{3}\sqrt{\langle v^2\rangle}dt
Por lo tanto, la probabilidad de colisión aumentará en un factor de \sqrt{2} en comparación con el caso en el que las partículas no se desplazan:
ID:(1963, 0)
Difusión de particulas
Concepto 
Si hay una diferencia espacial en la concentración de particulas (c_n), se genera un fenómeno conocido como variación de concentración (dc_n). La probabilidad de que las partículas lleguen a una posición a lo largo de un eje (z) desde una posición anterior a una distancia de el camino libre (\bar{l}) es diferente de la probabilidad desde una posición posterior a la misma distancia. Esto conduce a cambios en la concentración de particulas (c_n), lo que se denomina difusión. La velocidad a la que ocurre este proceso es la de la velocidad media de una partícula (\bar{v}), y en él participa siempre 1/6 de las partículas en cada dirección, ya que hay 6 direcciones en un espacio tridimensional.

De esta manera, se genera la densidad de flujo de partículas (j), que en términos de área corresponde a:
j=\displaystyle\frac{1}{6}\bar{v}c(z-\bar{l}) - \displaystyle\frac{1}{6}\bar{v}c(z+\bar{l})=\displaystyle\frac{1}{6}\bar{v}[c(z-\bar{l})-c(z+\bar{l})]=-\displaystyle\frac{1}{6}\bar{v}2\bar{l}\displaystyle\frac{dc}{dz}
Las constantes que se factorizan al calcular la densidad de flujo de partículas (j) se resumen en una constante que se denomina la constante de difusión (D) y que es igual a un tercio del producto de el camino libre (\bar{l}) y la velocidad media de una partícula (\bar{v}).
ID:(15143, 0)
Evaporación del agua en la napa
Concepto 
El cálculo de la densidad de flujo de partículas (j) en función de la variación de concentración (dc_n), variación de posición (dz) y la constante de difusión (D):
| j =- D \displaystyle\frac{ dc_n }{ dz } |
nos permite determinar cómo se evapora el agua de la capa freática. Para ello, se deben seguir los siguientes pasos:
• Obtener la temperatura ambiente, la humedad relativa, la porosidad del suelo y la profundidad de la capa freática.
• Calcular la temperatura del agua en la superficie de la capa freática.
• Calcular la concentración saturada de vapor de agua sobre la capa freática.
• Calcular la concentración de vapor de agua sobre el suelo.
• Calcular el flujo de vapor de agua para el límite de flujo estacionario.
ID:(15145, 0)
Modelo
Top 
Parámetros
Variables
Cálculos
Cálculos
Cálculos
Ecuaciones
c_m \equiv\displaystyle\frac{ n }{ V }
c_m = n / V
c_n = N_A c_m
c_n = N_A * c_m
c_n =\displaystyle\frac{ \rho }{ m }
c_n = rho / m
D =\displaystyle\frac{1}{3} \bar{v} \bar{l}
D = v * l /3
E =\displaystyle\frac{ f }{2} k_B T
E = f * k_B * T /2
j =- D \displaystyle\frac{ dc_n }{ dz }
j =- D * dc_n / dz
\vec{j} =- D \nabla c_n
j =-D * nabla c_n
K =\displaystyle\frac{ m }{2} \bar{v} ^2
K = m * v ^2/2
l =\displaystyle\frac{1}{ d ^2 \pi c_n }
l = 1/( d ^2 * pi * c )
m =\displaystyle\frac{ M_m }{ N_A }
m = M_m / N_A
n = \displaystyle\frac{ M }{ M_m }
n = M / M_m
n \equiv\displaystyle\frac{ N }{ N_A }
n = N / N_A
\bar{v} =\sqrt{\displaystyle\frac{ f k_B T }{ m }}
v =sqrt( f * k_B * T / m )
\displaystyle\frac{\partial c_n}{\partial t } = \displaystyle\frac{ \partial }{ \partial z }\left( D \displaystyle\frac{ \partial c_n }{ \partial z }\right)
@DIFF( c_n, t, 1) = @DIFF( D * @DIFF( c_n , z , 1), z , 1)
l=\displaystyle\frac{1}{\sqrt{2}\pi d^2c_n}
l = 1 / ( sqrt(2) * pi * d^2 * c_n )
ID:(15232, 0)
Concentración molar
Ecuación 
La concentración molar (c_m) corresponde al número de moles (n) por el volumen (V) de un gas y se calcula como sigue:
ID:(4878, 0)
Número de moles
Ecuación 
El número de moles (n) corresponde a el número de partículas (N) dividido por el número de Avogadro (N_A):
ID:(3748, 0)
Concentración partículas y moles
Ecuación 
Para convertir la concentración molar (c_m) en la concentración de particulas (c_n), simplemente multiplique la primera por el número de Avogadro (N_A), así:
ID:(10624, 0)
Número de moles con masa molar
Ecuación 
El número de moles (n) se determina dividiendo la masa (M) de una sustancia por su la masa molar (M_m), que corresponde al peso de un mol de la sustancia.
Por lo tanto, se puede establecer la siguiente relación:
El número de moles (n) corresponde a el número de partículas (N) dividido por el número de Avogadro (N_A):
| n \equiv\displaystyle\frac{ N }{ N_A } |
Si multiplicamos el numerador y el denominador por la masa de la partícula (m), obtenemos:
n=\displaystyle\frac{N}{N_A}=\displaystyle\frac{Nm}{N_Am}=\displaystyle\frac{M}{M_m}
Así que es:
| n = \displaystyle\frac{ M }{ M_m } |
La masa molar se expresa en gramos por mol (g/mol).
ID:(4854, 0)
Concentración en base a masa molar
Ecuación 
Si dividimos la densidad (\rho) por la masa de la partícula (m), obtendremos la concentración de particulas (c_n):
Dado la concentración de particulas (c_n) con el número de partículas (N) y el volumen (V), obtenemos:
| c_n \equiv \displaystyle\frac{ N }{ V } |
Con la masa de la partícula (m) y la masa (M),
| m \equiv \displaystyle\frac{ M }{ N } |
Como la densidad (\rho) es
| \rho \equiv\displaystyle\frac{ M }{ V } |
obtenemos
c_n=\displaystyle\frac{N}{V}=\displaystyle\frac{M}{mV}=\displaystyle\frac{\rho}{m}
Por lo tanto,
| c_n =\displaystyle\frac{ \rho }{ m } |
ID:(10623, 0)
Camino libre con concentración de partículas
Ecuación 
El camino libre medio se puede estimar en función del diámetro de un cilindro imaginario que rodea una partícula, teniendo en promedio una colisión con otra partícula.
El radio del cilindro corresponde a la distancia máxima que dos partículas deben tener para colisionar, lo que equivale a dos veces el radio de la partícula, es decir, el diámetro de la partícula (d). Dado que solo ocurre una colisión en este cilindro, el número de partículas contenidas en él debe ser igual a uno. Esto significa que:
l d^2\pi c_n= 1
con la concentración de particulas (c_n) y resolviendo para el camino libre (\bar{l}), obtenemos:
Esto representa el camino libre medio.
ID:(4392, 0)
Camino libre medio para vecinos en movimiento
Ecuación 
Para el caso sin movimiento, la probabilidad es de el camino libre (\bar{l}), mientras que con movimiento, las probabilidades son de el diámetro de la partícula (d) y la concentración de particulas (c_n), respectivamente.
| l =\displaystyle\frac{1}{ \pi d ^2 c_n } |
En el caso del movimiento, la probabilidad se incrementa en un factor de \sqrt{2}, lo que significa que el camino libre es
ID:(3943, 0)
Energía cinética de la partícula
Ecuación 
La energía cinética (K) junto con la masa de la partícula (m) y la velocidad media de una partícula (\bar{v}) es igual a
Nota: En un rigor más estricto, la energía cinética depende del promedio de la velocidad al cuadrado \bar{v^2}. Sin embargo, se asume que este es aproximadamente igual al cuadrado del promedio de la velocidad:
\bar{v^2}\sim\bar{v}^2
ID:(4390, 0)
Masa de la partícula y masa molar
Ecuación 
La masa de la partícula (m) puede estimarse a partir de la masa molar (M_m) y el número de Avogadro (N_A) mediante
ID:(4389, 0)
Energía en función de grados de libertad
Ecuación 
La ley de Stefan-Boltzmann, inicialmente propuesta por Josef Stefan [1] y posteriormente refinada por Ludwig Boltzmann [2], establece que la energía de una molécula (E) es proporcional a el grados de libertad (f) multiplicado por la temperatura absoluta (T) con una constante de proporcionalidad la constante de Boltzmann (k_B):
Es importante destacar que la temperatura absoluta (T) debe expresarse necesariamente en grados Kelvin.
El número de grados de libertad de una partícula corresponde al número de variables necesarias para describir su estado termodinámico. Por ejemplo, para una partícula puntual, se requieren solo tres coordenadas, lo que da lugar a tres grados de libertad. Si la partícula tiene forma y es rígida, se necesitan además dos ángulos, lo que resulta en un total de cinco grados de libertad. Cuando la partícula puede deformarse o vibrar en una o más direcciones, estos modos adicionales también se consideran grados de libertad. Sin embargo, es importante notar que estos grados de libertad adicionales solo existen a altas temperaturas, cuando la partícula tiene suficiente energía para activar dichas vibraciones.
[1] "Über die Beziehung zwischen der Wärmestrahlung und der Temperatur" (Sobre la relación entre la radiación de calor y la temperatura), Josef Stefan, Sitzungsberichte der mathematisch-naturwissenschaftlichen Classe der Kaiserlichen Akademie der Wissenschaften, Wien (1879).
[2] "Weitere Studien über das Wärmegleichgewicht unter Gasmolekülen" (Más estudios sobre el equilibrio térmico entre moléculas de gas), Ludwig Boltzmann, Sitzungsberichte der mathematisch-naturwissenschaftlichen Classe der Kaiserlichen Akademie der Wissenschaften, Wien (1884).
ID:(4387, 0)
Velocidad media de las partículas
Ecuación 
Si se iguala la energía cinética (K) con la energía de una molécula (E) se puede calcular en función de el grados de libertad (f), la constante de Boltzmann (k_B), la temperatura absoluta (T) y la masa de la partícula (m) lo que es la velocidad media de una partícula (\bar{v}) mediante
La energía cinética (K) con la masa de la partícula (m) y la velocidad media de una partícula (\bar{v})
| K =\displaystyle\frac{ m }{2} \bar{v} ^2 |
y la energía de una molécula (E) con el grados de libertad (f), la constante de Boltzmann (k_B) y la temperatura absoluta (T)
| E =\displaystyle\frac{ f }{2} k_B T |
que al igualar dan
| \bar{v} =\sqrt{\displaystyle\frac{ f k_B T }{ m }} |
ID:(4391, 0)
Constante de difusión
Ecuación 
La constante de difusión (D) se puede calcular a partir de la velocidad media de una partícula (\bar{v}) y de el camino libre (\bar{l}) de las partículas.
Es importante reconocer que tanto el camino libre como la velocidad media dependen de la temperatura, y por lo tanto, también lo hace la constante de difusión. Por esta razón, cuando se publican valores para la llamada constante, siempre se indica la temperatura a la que se refiere.
ID:(3186, 0)
Ley de Fick en una dimensión
Ecuación 
En 1855, Adolf Fick [1] formuló una ecuación para el cálculo de la constante de difusión (D), que resulta en la densidad de flujo de partículas (j) debido a la variación de concentración (dc_n) a lo largo de variación de posición (dz):
[1] "Über Diffusion" (Sobre difusión), Adolf Fick, Annalen der Physik und Chemie, Volume 170, páginas 59-86 (1855)
ID:(4820, 0)
Ley de Fick en más dimensiones
Ecuación 
El cálculo de la densidad de flujo de partículas (j) en una dimensión se realiza utilizando los valores la constante de difusión (D), la concentración de particulas (c_n) y la posición a lo largo de un eje (z), de acuerdo con la siguiente ley de Fick [1]:
| j =- D \displaystyle\frac{ dc_n }{ dz } |
Esta fórmula se puede generalizar para más de una dimensión según:
[1] "Über Diffusion" (Sobre difusión), Adolf Fick, Annalen der Physik und Chemie, Volume 170, páginas 59-86 (1855)
ID:(4821, 0)
Ecuación de difusión de particulas
Ecuación 
Si la constante de difusión (D) es igual a la densidad de flujo de partículas (j) debido a la variación de concentración (dc_n) a lo largo de variación de posición (dz), esto se rige por la ley de Fick [1]:
| j =- D \displaystyle\frac{ dc_n }{ dz } |
Por lo tanto, para describir la variación de la concentración en el tiempo (t), que corresponde a la variación espacial de la densidad de flujo, obtenemos la ecuación
[1] "Über Diffusion" (Sobre difusión), Adolf Fick, Annalen der Physik und Chemie, Volumen 170, páginas 59-86 (1855)
ID:(15144, 0)
