Primeira Lei da Termodinâmica
Storyboard 
A primeira lei da termodinâmica estabelece que a energia é conservada e consiste em duas partes: uma associada ao trabalho e outra ao calor. Diferentemente do trabalho, esta última parte não pode ser completamente convertida em trabalho, o que limita as conversões energéticas possíveis.
ID:(1398, 0)
Mecanismos
Definição 
A primeira lei da termodinâmica, também conhecida como lei da conservação da energia, afirma que a energia não pode ser criada nem destruída em um sistema isolado; ela pode apenas ser transferida ou transformada. Esse princípio estabelece que a energia total de um sistema isolado permanece constante. Em termos práticos, isso significa que a mudança na energia interna de um sistema é igual ao calor adicionado ao sistema menos o trabalho realizado pelo sistema. A energia interna abrange a energia total dentro de um sistema, incluindo a energia cinética e potencial a nível molecular. O calor é a energia transferida entre sistemas devido a uma diferença de temperatura, enquanto o trabalho é a energia transferida quando uma força é aplicada sobre uma distância, frequentemente relacionada a mudanças de volume em gases. A primeira lei é fundamental para analisar a eficiência de motores térmicos, o desempenho de sistemas de refrigeração e aquecimento e para entender processos metabólicos em sistemas biológicos. Ela fornece uma base para compreender as transferências e transformações de energia em vários processos físicos, garantindo que a energia dentro de um sistema isolado seja sempre conservada.
ID:(15250, 0)
Conservação de energia
Imagem 
A primeira lei da termodinâmica estabelece que a energia é sempre conservada.
Enquanto na mecânica existe uma conservação similar, restrita a sistemas não dissipativos (por exemplo, excluindo o atrito), na termodinâmica essa lei é generalizada, considerando não apenas o trabalho mecânico, mas também o calor gerado ou absorvido pelo sistema.
Nesse sentido, a conservação de energia postulada na termodinâmica não possui restrições e é aplicável a todos os sistemas, desde que sejam consideradas todas as trocas e conversões de energia possíveis.
ID:(37, 0)
Primeira lei da termodinâmica
Nota 
A primeira lei da termodinâmica foi desenvolvida através de vários trabalhos [1,2], estabelecendo que a energia se conserva. Isso significa que o diferencial de energia interna ($dU$) é sempre igual a o diferencial de calor impreciso ($\delta Q$) fornecida ao sistema (positivo) menos o diferencial de trabalho impreciso ($\delta W$) realizada pelo sistema (negativo).
Portanto, temos:
| $ dU = \delta Q - \delta W $ |
Enquanto o diferencial exato não depende de como a variação é executada, o diferencial inexato depende. Quando nos referimos a um diferencial sem especificar que é inexato, assume-se que é exato.
![]() [1] "Über die quantitative und qualitative Bestimmung der Kräfte" (Sobre a Determinação Quantitativa e Qualitativa das Forças), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
[1] "Über die quantitative und qualitative Bestimmung der Kräfte" (Sobre a Determinação Quantitativa e Qualitativa das Forças), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
![]() [2] "Über die Erhaltung der Kraft" (Sobre a Conservação da Força), Hermann von Helmholtz, 1847
[2] "Über die Erhaltung der Kraft" (Sobre a Conservação da Força), Hermann von Helmholtz, 1847
ID:(15700, 0)
Pressão e trabalho
Citar 
Consideremos um gás em um cilindro onde um pistão pode se deslocar. Se o pistão for movido, é possível reduzir o volume, comprimindo o gás. Para realizar essa compressão, é necessária uma energia que é igual à força exercida pelo gás multiplicada pela distância percorrida pelo pistão. Essa energia também pode ser representada em função da pressão, já que a pressão é definida pela força e pela área do pistão.
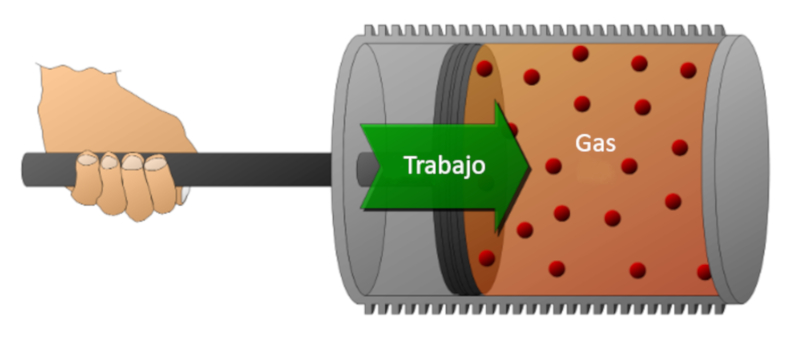
O trabalho pode ser realizado pelo sistema (compressão) ou pelo sistema sobre o meio externo (expansão).
Uma vez que la força mecânica ($F$) dividido por la seção ($S$) é igual a la pressão ($p$):
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
e la variação de volume ($\Delta V$) com o distância percorrida ($dx$) é igual a:
| $ \Delta V = S \Delta s $ |
A equação para o diferencial de trabalho impreciso ($\delta W$) pode ser expressa como:
| $ \delta W = F dx $ |
Portanto, ela pode ser escrita como:
| $ \delta W = p dV $ |
ID:(11126, 0)
Primeira lei da termodinâmica e pressão
Exercício 
Uma vez que o diferencial de energia interna ($dU$) está relacionado com o diferencial de calor impreciso ($\delta Q$) e o diferencial de trabalho impreciso ($\delta W$) da seguinte forma:
| $ dU = \delta Q - \delta W $ |
E é sabido que o diferencial de trabalho impreciso ($\delta W$) está relacionado com la pressão ($p$) e la variação de volume ($\Delta V$) como segue:
| $ \delta W = p dV $ |
Portanto, podemos concluir que:
| $ dU = \delta Q - p dV $ |
ID:(15701, 0)
Primeira Lei da Termodinâmica
Descrição 
A primeira lei da termodinâmica estabelece que a energia é conservada e consiste em duas partes: uma associada ao trabalho e outra ao calor. Diferentemente do trabalho, esta última parte não pode ser completamente convertida em trabalho, o que limita as conversões energéticas possíveis.
Variáveis
Cálculos
Cálculos
Equações
(ID 3202)
Uma vez que la força mecânica ($F$) dividido por la seção ($S$) igual a la pressão ($p$):
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
e la variação de volume ($\Delta V$) com o distância percorrida ($dx$) igual a:
| $ \Delta V = S \Delta s $ |
A equa o para o diferencial de trabalho impreciso ($\delta W$) pode ser expressa como:
| $ \delta W = F dx $ |
Portanto, ela pode ser escrita como:
| $ \delta W = p dV $ |
(ID 3468)
(ID 3469)
Uma vez que o diferencial de energia interna ($dU$) est relacionado com o diferencial de calor impreciso ($\delta Q$) e o diferencial de trabalho impreciso ($\delta W$) da seguinte forma:
| $ dU = \delta Q - \delta W $ |
E sabido que o diferencial de trabalho impreciso ($\delta W$) est relacionado com la pressão ($p$) e la variação de volume ($\Delta V$) como segue:
| $ \delta W = p dV $ |
Portanto, podemos concluir que:
| $ dU = \delta Q - p dV $ |
(ID 3470)
(ID 15700)
(ID 15701)
Exemplos
A primeira lei da termodin mica, tamb m conhecida como lei da conserva o da energia, afirma que a energia n o pode ser criada nem destru da em um sistema isolado; ela pode apenas ser transferida ou transformada. Esse princ pio estabelece que a energia total de um sistema isolado permanece constante. Em termos pr ticos, isso significa que a mudan a na energia interna de um sistema igual ao calor adicionado ao sistema menos o trabalho realizado pelo sistema. A energia interna abrange a energia total dentro de um sistema, incluindo a energia cin tica e potencial a n vel molecular. O calor a energia transferida entre sistemas devido a uma diferen a de temperatura, enquanto o trabalho a energia transferida quando uma for a aplicada sobre uma dist ncia, frequentemente relacionada a mudan as de volume em gases. A primeira lei fundamental para analisar a efici ncia de motores t rmicos, o desempenho de sistemas de refrigera o e aquecimento e para entender processos metab licos em sistemas biol gicos. Ela fornece uma base para compreender as transfer ncias e transforma es de energia em v rios processos f sicos, garantindo que a energia dentro de um sistema isolado seja sempre conservada.
(ID 15250)
A primeira lei da termodin mica estabelece que a energia sempre conservada.
Enquanto na mec nica existe uma conserva o similar, restrita a sistemas n o dissipativos (por exemplo, excluindo o atrito), na termodin mica essa lei generalizada, considerando n o apenas o trabalho mec nico, mas tamb m o calor gerado ou absorvido pelo sistema.
Nesse sentido, a conserva o de energia postulada na termodin mica n o possui restri es e aplic vel a todos os sistemas, desde que sejam consideradas todas as trocas e convers es de energia poss veis.
(ID 37)
A primeira lei da termodin mica foi desenvolvida atrav s de v rios trabalhos [1,2], estabelecendo que a energia se conserva. Isso significa que o diferencial de energia interna ($dU$) sempre igual a o diferencial de calor impreciso ($\delta Q$) fornecida ao sistema (positivo) menos o diferencial de trabalho impreciso ($\delta W$) realizada pelo sistema (negativo).
Portanto, temos:
| $ dU = \delta Q - \delta W $ |
Enquanto o diferencial exato n o depende de como a varia o executada, o diferencial inexato depende. Quando nos referimos a um diferencial sem especificar que inexato, assume-se que exato.
![]() [1] " ber die quantitative und qualitative Bestimmung der Kr fte" (Sobre a Determina o Quantitativa e Qualitativa das For as), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
[1] " ber die quantitative und qualitative Bestimmung der Kr fte" (Sobre a Determina o Quantitativa e Qualitativa das For as), Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
![]() [2] " ber die Erhaltung der Kraft" (Sobre a Conserva o da For a), Hermann von Helmholtz, 1847
[2] " ber die Erhaltung der Kraft" (Sobre a Conserva o da For a), Hermann von Helmholtz, 1847
(ID 15700)
Consideremos um g s em um cilindro onde um pist o pode se deslocar. Se o pist o for movido, poss vel reduzir o volume, comprimindo o g s. Para realizar essa compress o, necess ria uma energia que igual for a exercida pelo g s multiplicada pela dist ncia percorrida pelo pist o. Essa energia tamb m pode ser representada em fun o da press o, j que a press o definida pela for a e pela rea do pist o.

O trabalho pode ser realizado pelo sistema (compress o) ou pelo sistema sobre o meio externo (expans o).
Uma vez que la força mecânica ($F$) dividido por la seção ($S$) igual a la pressão ($p$):
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
e la variação de volume ($\Delta V$) com o distância percorrida ($dx$) igual a:
| $ \Delta V = S \Delta s $ |
A equa o para o diferencial de trabalho impreciso ($\delta W$) pode ser expressa como:
| $ \delta W = F dx $ |
Portanto, ela pode ser escrita como:
| $ \delta W = p dV $ |
(ID 11126)
Uma vez que o diferencial de energia interna ($dU$) est relacionado com o diferencial de calor impreciso ($\delta Q$) e o diferencial de trabalho impreciso ($\delta W$) da seguinte forma:
| $ dU = \delta Q - \delta W $ |
E sabido que o diferencial de trabalho impreciso ($\delta W$) est relacionado com la pressão ($p$) e la variação de volume ($\Delta V$) como segue:
| $ \delta W = p dV $ |
Portanto, podemos concluir que:
| $ dU = \delta Q - p dV $ |
(ID 15701)
(ID 15309)
O diferencial de energia interna ($dU$) sempre igual quantidade de o diferencial de calor impreciso ($\delta Q$) fornecida ao sistema (positiva) menos a quantidade de o diferencial de trabalho impreciso ($\delta W$) realizada pelo sistema (negativa):
| $ dU = \delta Q - \delta W $ |
(ID 9632)
La variação de trabalho ($\Delta W$) é definido como o produto de la força com massa constante ($F$) e la distância percorrida em um tempo ($\Delta s$):
| $ \Delta W = F \Delta s $ |
(ID 3202)
La pressão da coluna de água ($p$) calculado a partir de la força da coluna ($F$) e la altura da coluna líquida ($S$) da seguinte forma:
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
(ID 4342)
Se tivermos um tubo com uma la seção de tubo ($S$) que se desloca uma dist ncia de o elemento de tubo ($\Delta s$) ao longo do seu eixo, tendo deslocado o elemento de volume ($\Delta V$), ent o igual a:
| $ \Delta V = S \Delta s $ |
(ID 3469)
O diferencial de trabalho impreciso ($\delta W$) igual a la pressão ($p$) multiplicado por la variação de volume ($\Delta V$):
| $ \delta W = p dV $ |
(ID 3468)
Com a primeira lei da termodin mica, pode ser expressa em termos de o diferencial de energia interna ($dU$), o diferencial de calor impreciso ($\delta Q$), la pressão ($p$) e la variação de volume ($\Delta V$) como:
| $ dU = \delta Q - p dV $ |
(ID 3470)
ID:(1398, 0)
