Princípio de Avogadro
Storyboard 
O princípio de Avogadro estabelece que a divisão de o número de moles ($n$) por o volume ($V$) é constante, enquanto la pressão ($p$) e la temperatura absoluta ($T$) são constantes.
Isso significa que o número de moles ($n$) varia proporcionalmente a o volume ($V$).
ID:(1475, 0)
Mecanismos
Conceito 
O princípio de Avogadro estabelece que volumes iguais de gases, à mesma temperatura e pressão, contêm o mesmo número de moléculas. Isso significa que o volume de um gás é diretamente proporcional ao número de moléculas (ou mols) presentes quando a temperatura e a pressão são mantidas constantes. Este princípio é fundamental para entender o comportamento dos gases e forma a base da lei dos gases ideais. Ele permite determinar a quantidade de gás em um determinado volume e é essencial para cálculos que envolvem reações químicas e misturas de gases.
ID:(15257, 0)
Variação de volume e número de moles
Conceito 
Existem variáveis intensivas e extensivas. As primeiras são características do estado do sistema e não dependem do tamanho deste. Dois exemplos são la pressão ($p$) e la temperatura absoluta ($T$). Se desejamos um sistema maior que este em um mesmo estado, tanto la pressão ($p$) quanto la temperatura absoluta ($T$) devem permanecer iguais.
A situação é diferente com o volume ($V$), que é uma variável extensiva, ou seja, se for necessário um sistema maior, ela terá que aumentar na proporção correspondente. O mesmo ocorre com o número total de moles ($n$):
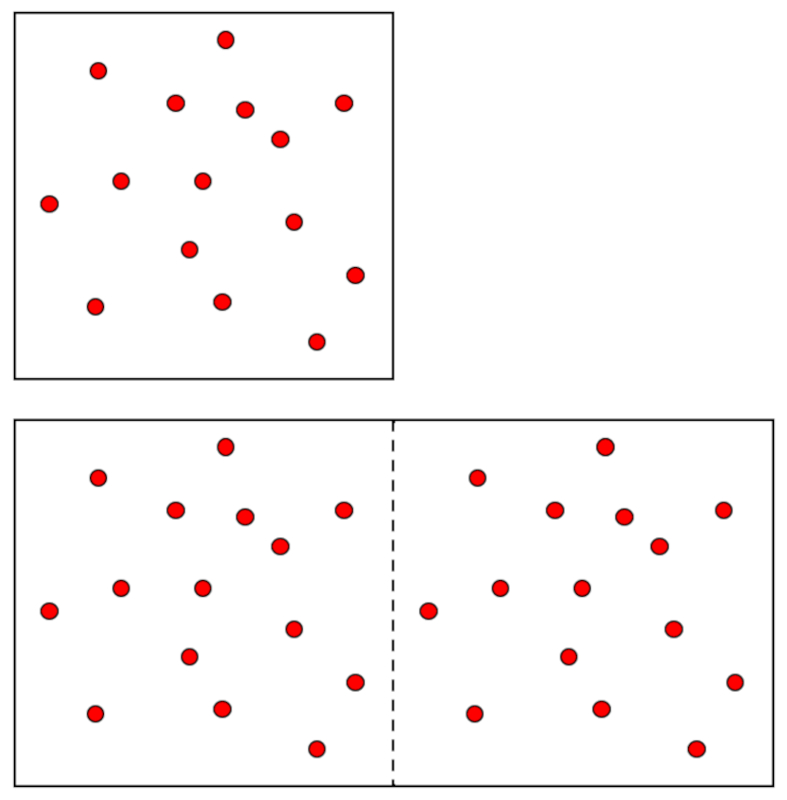
Além disso, ambas devem aumentar na mesma proporção, então, se la pressão ($p$) e la temperatura absoluta ($T$) forem constantes, serão proporcionais entre si:
$n \propto V$
ID:(15696, 0)
Moles e razão de volume
Descrição 
Em um gás, quando as constantes la pressão ($p$) e la temperatura absoluta ($T$) são mantidas, observa-se uma relação proporcional entre o volume ($V$) e o número de moles ($n$). Cada vez que o volume ($V$) aumenta, é observado que o número de moles ($n$) também aumenta, e vice-versa,
$n \propto V$
como mostrado no gráfico a seguir:

A Lei de Avogadro [1] afirma que o volume ($V$) e o número de moles ($n$) são diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) são mantidos constantes.
Essa relação pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Ensaio sobre um Método para Determinar as Massas Relativas das Moléculas Elementares dos Corpos e as Proporções nas Quais Elas Entram em Suas Combinações," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Ensaio sobre um Método para Determinar as Massas Relativas das Moléculas Elementares dos Corpos e as Proporções nas Quais Elas Entram em Suas Combinações," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
ID:(9532, 0)
Amadeo Avogadro
Descrição 
Amadeo Avogadro, cujo nome completo era Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, foi um cientista italiano nascido em 9 de agosto de 1776 e falecido em 9 de julho de 1856. Avogadro é conhecido principalmente por suas contribuições para o desenvolvimento da teoria molecular e a formulação da lei de Avogadro. Ele propôs que volumes iguais de gases, à mesma temperatura e pressão, contêm o mesmo número de partículas, o que é conhecido como o princípio de Avogadro ou a lei de Avogadro. Esse conceito foi fundamental para o desenvolvimento do conceito de molécula e estabeleceu as bases para entender as relações entre a quantidade de substância, o volume e o número de partículas em gases. Apesar de suas importantes contribuições, o trabalho de Avogadro não foi amplamente reconhecido durante sua vida, e suas ideias ganharam maior aceitação anos após sua morte. Atualmente, Avogadro é homenageado por suas contribuições fundamentais para a química e é considerado um dos pioneiros da teoria molecular moderna.
ID:(1659, 0)
Mudança de estado de um gás ideal de acordo com a lei de Avogadro
Conceito 
O princípio de Avogadro estabelece que quando la pressão ($p$) e la temperatura absoluta ($T$) são mantidos constantes, a proporção de ERROR:6679 para o volume ($V$) é igual a la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Isso significa que se um gás passa de um estado inicial (o número de moles no estado i ($n_i$) e o volume no estado i ($V_i$)) para um estado final (o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$)) mantendo la pressão ($p$) e la temperatura absoluta ($T$) constantes, a lei de Gay-Lussac sempre deve ser cumprida:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Portanto, temos:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
ID:(15695, 0)
Princípio de Avogadro
Modelo 
O princípio de Avogadro estabelece que a divisão de 9339 por 5226 é constante, enquanto 5224 e 5177 são constantes. Isso significa que 9339 varia proporcionalmente a 5226.
Variáveis
Cálculos
Cálculos
Equações
O princ pio de Avogadro estabelece que quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes, a propor o de ERROR:6679 para o volume ($V$) igual a la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Isso significa que se um g s passa de um estado inicial (o número de moles no estado i ($n_i$) e o volume no estado i ($V_i$)) para um estado final (o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$)) mantendo la pressão ($p$) e la temperatura absoluta ($T$) constantes, a lei de Gay-Lussac sempre deve ser cumprida:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Portanto, temos:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
(ID 3489)
Exemplos
O princ pio de Avogadro estabelece que volumes iguais de gases, mesma temperatura e press o, cont m o mesmo n mero de mol culas. Isso significa que o volume de um g s diretamente proporcional ao n mero de mol culas (ou mols) presentes quando a temperatura e a press o s o mantidas constantes. Este princ pio fundamental para entender o comportamento dos gases e forma a base da lei dos gases ideais. Ele permite determinar a quantidade de g s em um determinado volume e essencial para c lculos que envolvem rea es qu micas e misturas de gases.
(ID 15257)
Existem vari veis intensivas e extensivas. As primeiras s o caracter sticas do estado do sistema e n o dependem do tamanho deste. Dois exemplos s o la pressão ($p$) e la temperatura absoluta ($T$). Se desejamos um sistema maior que este em um mesmo estado, tanto la pressão ($p$) quanto la temperatura absoluta ($T$) devem permanecer iguais.
A situa o diferente com o volume ($V$), que uma vari vel extensiva, ou seja, se for necess rio um sistema maior, ela ter que aumentar na propor o correspondente. O mesmo ocorre com o número total de moles ($n$):

Al m disso, ambas devem aumentar na mesma propor o, ent o, se la pressão ($p$) e la temperatura absoluta ($T$) forem constantes, ser o proporcionais entre si:
$n \propto V$
(ID 15696)
Em um g s, quando as constantes la pressão ($p$) e la temperatura absoluta ($T$) s o mantidas, observa-se uma rela o proporcional entre o volume ($V$) e o número de moles ($n$). Cada vez que o volume ($V$) aumenta, observado que o número de moles ($n$) tamb m aumenta, e vice-versa,
$n \propto V$
como mostrado no gr fico a seguir:

A Lei de Avogadro [1] afirma que o volume ($V$) e o número de moles ($n$) s o diretamente proporcionais quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes.
Essa rela o pode ser expressa da seguinte forma, usando la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
![]() [1] "Ensaio sobre um M todo para Determinar as Massas Relativas das Mol culas Elementares dos Corpos e as Propor es nas Quais Elas Entram em Suas Combina es," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
[1] "Ensaio sobre um M todo para Determinar as Massas Relativas das Mol culas Elementares dos Corpos e as Propor es nas Quais Elas Entram em Suas Combina es," Amedeo Avogadro, Journal de Physique, 73, 58-76 (1811).
(ID 9532)
Amadeo Avogadro, cujo nome completo era Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto, foi um cientista italiano nascido em 9 de agosto de 1776 e falecido em 9 de julho de 1856. Avogadro conhecido principalmente por suas contribui es para o desenvolvimento da teoria molecular e a formula o da lei de Avogadro. Ele prop s que volumes iguais de gases, mesma temperatura e press o, cont m o mesmo n mero de part culas, o que conhecido como o princ pio de Avogadro ou a lei de Avogadro. Esse conceito foi fundamental para o desenvolvimento do conceito de mol cula e estabeleceu as bases para entender as rela es entre a quantidade de subst ncia, o volume e o n mero de part culas em gases. Apesar de suas importantes contribui es, o trabalho de Avogadro n o foi amplamente reconhecido durante sua vida, e suas ideias ganharam maior aceita o anos ap s sua morte. Atualmente, Avogadro homenageado por suas contribui es fundamentais para a qu mica e considerado um dos pioneiros da teoria molecular moderna.
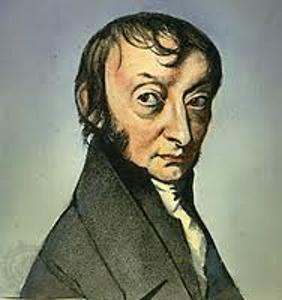
(ID 1659)
O princ pio de Avogadro estabelece que quando la pressão ($p$) e la temperatura absoluta ($T$) s o mantidos constantes, a propor o de ERROR:6679 para o volume ($V$) igual a la constante do princípio de Avogadro ($C_a$):
| $\displaystyle\frac{ n }{ V } = C_a $ |
Isso significa que se um g s passa de um estado inicial (o número de moles no estado i ($n_i$) e o volume no estado i ($V_i$)) para um estado final (o número de moles no estado f ($n_f$) e o volume no estado f ($V_f$)) mantendo la pressão ($p$) e la temperatura absoluta ($T$) constantes, a lei de Gay-Lussac sempre deve ser cumprida:
$\displaystyle\frac{n_i}{V_i}=C_a=\displaystyle\frac{n_f}{V_f}$
Portanto, temos:
| $\displaystyle\frac{ n_i }{ V_i }=\displaystyle\frac{ n_f }{ V_f }$ |
(ID 15695)
(ID 15316)
ID:(1475, 0)
