Charles-Gesetz
Storyboard 
Das Gesetz von Charles besagt, dass das Verhältnis von der Volumen ($V$) zu die Absolute Temperatur ($T$) eines Gases konstant bleibt, vorausgesetzt, dass der Druck und die Stoffmenge unverändert bleiben.
Das bedeutet, dass der Volumen ($V$) proportional zu die Absolute Temperatur ($T$) variiert.
ID:(1473, 0)
Charles-Gesetz
Storyboard 
Das Gesetz von Charles besagt, dass das Verhältnis von 5226 zu 5177 eines Gases konstant bleibt, vorausgesetzt, dass der Druck und die Stoffmenge unverändert bleiben. Das bedeutet, dass 5226 proportional zu 5177 variiert.
Variablen
Berechnungen
Berechnungen
Gleichungen
Das Gesetz von Charles besagt, dass bei konstantem die Druck ($p$) das Verh ltnis von der Volumen ($V$) zu die Absolute Temperatur ($T$) gleich die Charles-Gesetz-Konstante ($C_c$) ist:
Dies bedeutet, dass wenn ein Gas von einem Anfangszustand (der Volumen im Zustand i ($V_i$) und die Temperatur im Ausgangszustand ($T_i$)) zu einem Endzustand (der Volumen im Zustand f ($V_f$) und die Temperatur im Endzustand ($T_f$)) bergeht und dabei die Druck ($p$) konstant gehalten wird, es immer dem Gesetz von Charles gehorchen muss:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Daher ergibt sich:
In einem isobarischen Prozess, bei dem der Inhalt konstant bleibt, sind der Volumen im Zustand i ($V_i$), die Temperatur im Endzustand ($T_f$), die Temperatur im Ausgangszustand ($T_i$) und die Temperatur im Endzustand ($T_f$) durch folgende Beziehung verbunden:
Dann k nnen wir die Dichte ($\rho$) einf hren, das zusammen mit die Masse ($M$) und der Volumen ($V$) erf llt:
Dies f hrt uns zu die Dichte im Zustand i ($\rho_i$) und die Dichte im Zustand f ($\rho_f$) als:
Beispiele
Das Gesetz von Charles besagt, dass das Volumen eines Gases direkt proportional zu seiner Temperatur ist, wenn der Druck konstant bleibt. Das bedeutet, dass sich das Volumen eines Gases vergr ert, wenn die Temperatur steigt, vorausgesetzt, der Druck bleibt gleich. Umgekehrt verringert sich das Volumen, wenn die Temperatur sinkt. Diese Beziehung ist grundlegend f r das Verst ndnis des Verhaltens von Gasen und l sst sich oft beobachten, wenn ein Gas in einem flexiblen Beh lter, wie einem Ballon, erw rmt oder gek hlt wird, wobei die Temperatur nderung zu einer merklichen Volumen nderung f hrt.
Die Erzeugung von die Druck ($p$) erfolgt, wenn Gaspartikel mit der Oberfl che des Gasbeh lters kollidieren. Jede Kollision bertr gt einen Impuls, der dem Zweifachen von die Partikelmasse ($m$) mal die Durchschnittsgeschwindigkeit eines Teilchens ($\bar{v}$) entspricht. Es ist auch wichtig, den Partikelstrom zur Oberfl che zu ber cksichtigen, der von die Partikelkonzentration ($c_n$) abh ngt, aber auch von die Durchschnittsgeschwindigkeit eines Teilchens ($\bar{v}$), mit dem sie sich bewegen. Daher gilt:
$p \propto c_n v \cdot m v = c_n m v^2$
Der Partikelstrom und die Impuls bertragung sind im folgenden Diagramm dargestellt:
Da die Partikelmasse ($m$) mal die Durchschnittsgeschwindigkeit eines Teilchens ($\bar{v}$) quadratisch proportional zur Energie ist und diese zu die Absolute Temperatur ($T$),
$mv^2 \propto E \propto T$
und da der Anzahl der Partikel ($N$) konstant ist, ist die Partikelkonzentration ($c_n$) invers proportional zu der Volumen ($V$):
$c_n \propto \displaystyle\frac{1}{V}$
Da die Druck ($p$) konstant ist, haben wir:
$p \propto \displaystyle\frac{T}{V}$
was impliziert:
$V \propto T$
Die Temperatur entspricht der thermischen Energie (Bewegung), die in einem K rper enthalten ist.
Da Energie immer positiv ist, k nnen Temperaturen in Skalen wie Celsius und Fahrenheit, die negative Werte annehmen k nnen, wenig Sinn ergeben. Die Beziehung zwischen Energie und Temperatur f hrt jedoch zur Schlussfolgerung, dass es eine absolute Nulltemperatur geben muss, bei der die Energie eines Systems von Teilchen gleich null ist.
Dar ber hinaus beobachtete Gay-Lussac im Jahr 1802, dass es in Gasen eine proportionale Beziehung zwischen Volumen und Temperatur gibt. Diese Proportionalit t impliziert, dass ein Gas ein Volumen von null bei einer Temperatur von -273,15 Grad Celsius (nach modernen Messungen) erreichen w rde, was als absolute Nulltemperatur bekannt ist:
Dies impliziert die Existenz einer solchen Skala, die als absolute Temperaturskala in Kelvingraden bezeichnet wird. Andere Skalen wie Temperaturen $t$ in Celsius- oder Fahrenheitgraden k nnen in
Celsius:
$T = 273.15 + t$
Fahrenheit:
$T = 255.37 + \displaystyle\frac{5}{9} t$
Die Temperaturdifferenz in Grad Celsius ($\Delta t$) in Kombination mit die Temperatur in Grad Celsius in Zustand 1 ($t_1$) und die Temperatur in Grad Celsius in den Zustand 2 ($t_2$) ergibt:
$\Delta t = t_2 - t_1$
Wenn wir beide Temperaturen in Kelvin ausdr cken, erhalten wir, dass die Temperatur im Zustand 1 ($T_1$) gleich ist:
$T_1 = t_1 + 273,15 , \text{K}$
und die Temperatur im Zustand 2 ($T_2$) gleich ist:
$T_2 = t_2 + 273,15 , \text{K}$
Daher wird die Differenz in Kelvin-Temperaturen, bezeichnet als die Temperaturdifferenz ($\Delta T$), wie folgt berechnet:
$\Delta T=T_2-T_1=t_2-t_1=\Delta t$
Dies impliziert:
Was bedeutet, dass der Unterschied zwischen Temperaturen in Celsius und Kelvin konstant bleibt.
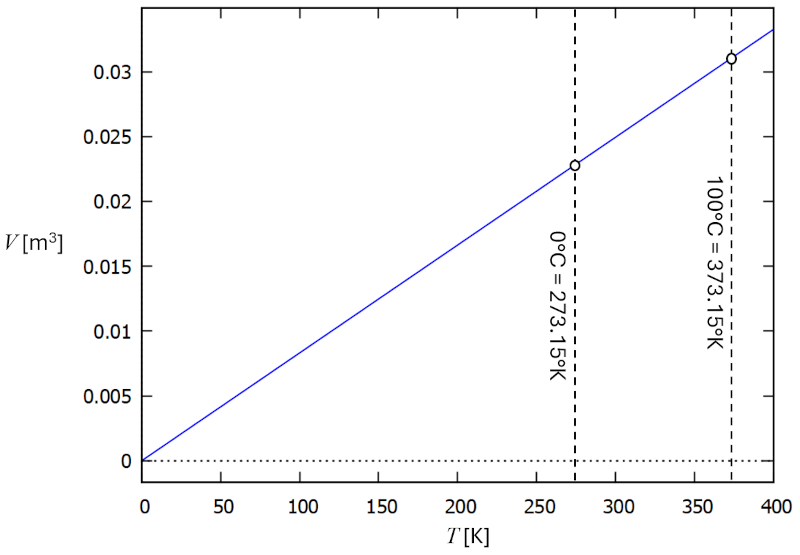
In einem Gas, wenn die Druck ($p$) und der Anzahl der Partikel ($N$) konstant gehalten werden, beobachtet man, dass der Volumen ($V$) und die Absolute Temperatur ($T$) proportional zueinander variieren. Wenn der Volumen ($V$) abnimmt, nimmt auch die Absolute Temperatur ($T$) ab, und umgekehrt,
$V \propto T$
wie in der folgenden Grafik dargestellt:
Das Gesetz von Charles [1] besagt, dass bei konstantem die Druck ($p$) und der Anzahl der Partikel ($N$) Der Volumen ($V$) und die Absolute Temperatur ($T$) direkt proportional sind.
Dies kann mit die Charles-Gesetz-Konstante ($C_c$) wie folgt ausgedr ckt werden:
![]() [1] "Sur la dilataci n de los gases y vapores" ( ber die Ausdehnung von Gasen und D mpfen), Jacques Charles, Franz sische Akademie der Wissenschaften (1787)
[1] "Sur la dilataci n de los gases y vapores" ( ber die Ausdehnung von Gasen und D mpfen), Jacques Charles, Franz sische Akademie der Wissenschaften (1787)
Jacques Charles, geboren am 12. November 1746 und gestorben am 7. April 1823, war ein franz sischer Physiker, Erfinder und Ballonfahrer. Er ist haupts chlich f r seine bahnbrechenden Arbeiten auf dem Gebiet der Luftfahrt und seine Entdeckungen im Zusammenhang mit dem Verhalten von Gasen bekannt. Im Jahr 1783 unternahm er gemeinsam mit dem Chemiker Nicolas-Louis Robert den ersten bemannten Flug mit einem mit Wasserstoff gef llten Ballon. Dieser erfolgreiche Flug markierte einen wichtigen Meilenstein in der Geschichte der Luftfahrt. Charles leistete auch wichtige Beitr ge zum Verst ndnis der Gasgesetze, einschlie lich des nach ihm benannten Gesetzes von Charles, das die Beziehung zwischen Volumen und Temperatur eines Gases bei konstantem Druck beschreibt.
Hinweis: Das Gesetz von Charles wurde von Joseph Louis Gay-Lussac ffentlich gemacht, der es Jacques Charles zuschrieb und dabei auf eine unver ffentlichte Artikelquelle verwies.
Das Gesetz von Charles besagt, dass bei konstantem die Druck ($p$) das Verh ltnis von der Volumen ($V$) zu die Absolute Temperatur ($T$) gleich die Charles-Gesetz-Konstante ($C_c$) ist:
Dies bedeutet, dass wenn ein Gas von einem Anfangszustand (der Volumen im Zustand i ($V_i$) und die Temperatur im Ausgangszustand ($T_i$)) zu einem Endzustand (der Volumen im Zustand f ($V_f$) und die Temperatur im Endzustand ($T_f$)) bergeht und dabei die Druck ($p$) konstant gehalten wird, es immer dem Gesetz von Charles gehorchen muss:
$\displaystyle\frac{V_i}{T_i} = C_c = \displaystyle\frac{V_f}{T_f}$
Daher ergibt sich:
In einem isobarischen Prozess, bei dem der Inhalt konstant bleibt, sind der Volumen im Zustand i ($V_i$), die Temperatur im Endzustand ($T_f$), die Temperatur im Ausgangszustand ($T_i$) und die Temperatur im Endzustand ($T_f$) durch folgende Beziehung verbunden:
Dann k nnen wir die Dichte ($\rho$) einf hren, das zusammen mit die Masse ($M$) und der Volumen ($V$) erf llt:
Dies f hrt uns zu die Dichte im Zustand i ($\rho_i$) und die Dichte im Zustand f ($\rho_f$) als:
Das Gesetz von Charles legt eine Beziehung zwischen der Volumen ($V$) und die Absolute Temperatur ($T$) fest und besagt, dass ihr Verh ltnis gleich die Charles-Gesetz-Konstante ($C_c$) ist, wie folgt:
Das Gesetz von Charles legt eine Beziehung zwischen der Volumen ($V$) und die Absolute Temperatur ($T$) fest und besagt, dass ihr Verh ltnis gleich die Charles-Gesetz-Konstante ($C_c$) ist, wie folgt:
Wenn ein Gas von einem Anfangszustand (i) zu einem Endzustand (f) bergeht und die Druck ($p$) konstant gehalten wird, gilt f r der Volumen im Zustand i ($V_i$), der Volumen im Zustand f ($V_f$), die Temperatur im Ausgangszustand ($T_i$) und die Temperatur im Endzustand ($T_f$):
F r die Anfangszust nde (die Dichte im Zustand i ($\rho_i$), der Volumen im Zustand i ($V_i$)) und Endzust nde (die Dichte im Zustand f ($\rho_f$), der Volumen im Zustand f ($V_f$)) ergibt sich das Gesetz von Charles wie folgt:
ID:(1473, 0)