Boyle-Mariotte-Gesetz
Storyboard 
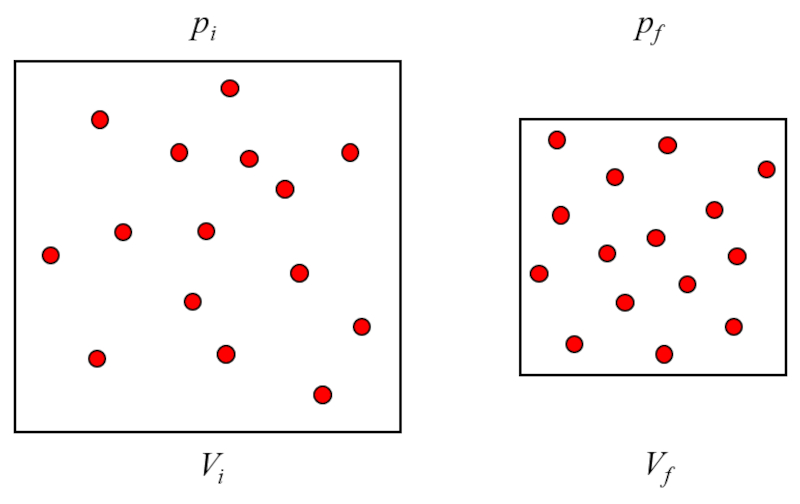
Das Gesetz von Boyle-Mariotte besagt, dass das Produkt von die Druck ($p$) und der Volumen ($V$) eines Gases konstant bleibt, wenn die absolute Temperatur und die Stoffmenge nicht variieren.
Das bedeutet, dass die Druck ($p$) umgekehrt proportional zu der Volumen ($V$) variiert.
ID:(1472, 0)
Boyle-Mariotte-Gesetz
Storyboard 
Das Gesetz von Boyle-Mariotte besagt, dass das Produkt von 5224 und 5226 eines Gases konstant bleibt, wenn die absolute Temperatur und die Stoffmenge nicht variieren. Das bedeutet, dass 5224 umgekehrt proportional zu 5226 variiert.
Variablen
Berechnungen
Berechnungen
Gleichungen
Das Boyle'sche Gesetz besagt, dass bei konstanter die Absolute Temperatur ($T$) das Produkt von die Druck ($p$) und der Volumen ($V$) gleich die Boyles Gesetzeskonstante ($C_b$) ist:
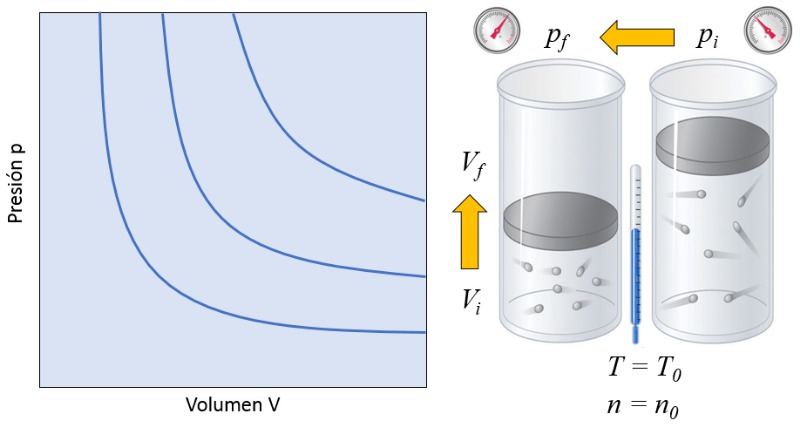
Das bedeutet, dass wenn ein Gas von einem Anfangszustand (die Druck im Ausgangszustand ($p_i$) und der Volumen im Zustand i ($V_i$)) in einen Endzustand (die Druck im Endzustand ($p_f$) und der Volumen im Zustand f ($V_f$)) bergeht und dabei die Absolute Temperatur ($T$) konstant bleibt, es immer das Boyle'sche Gesetz erf llen muss:
$p_i V_i = C_b = p_f V_f$
Daher ergibt sich:
Wenn bei einer isothermen nderung, bei der sich der Inhalt nicht ndert, die Druck im Ausgangszustand ($p_i$), die Druck im Endzustand ($p_f$), der Volumen im Zustand i ($V_i$) und der Volumen im Zustand f ($V_f$) durch folgende Gleichung in Beziehung stehen:
Dann kann die Dichte ($\rho$) eingef hrt werden, das zusammen mit die Masse ($M$) und der Volumen ($V$) folgende Bedingung erf llt:
Dies f hrt uns zu die Dichte im Zustand i ($\rho_i$) und die Dichte im Zustand f ($\rho_f$) als:
Beispiele
Das Boyle-Mariotte-Gesetz, auch einfach als Boyle'sches Gesetz bekannt, beschreibt die umgekehrte Beziehung zwischen dem Druck und dem Volumen eines Gases bei konstanter Temperatur. Es besagt, dass f r eine feste Menge Gas, wenn die Temperatur konstant gehalten wird, der Druck des Gases steigt, wenn das Volumen abnimmt, und umgekehrt. Das bedeutet, dass wenn man ein Gas durch Reduzierung seines Volumens komprimiert, der Druck proportional zunimmt, und wenn man das Volumen vergr ert, der Druck proportional abnimmt. Diese Beziehung ist grundlegend f r das Verst ndnis des Verhaltens von Gasen und wird mathematisch durch das Produkt von Druck und Volumen als eine Konstante f r eine gegebene Gasmenge bei konstanter Temperatur ausgedr ckt.
Die Druck ($p$) entsteht, wenn Gaspartikel mit der Oberfl che des Gasbeh lters kollidieren. Da die Absolute Temperatur ($T$) konstant ist, variiert die Energie der Partikel nicht, und die St e dieser Partikel mit den Oberfl chen des Gasbeh lters werden sich im bertragenen Impuls nicht ndern. Die Anzahl der St e h ngt jedoch von der Anzahl der Partikel in der N he der Oberfl che ab, was wiederum proportional zum die Partikelkonzentration ($c_n$) des Gases ist.
Auf der anderen Seite ist die Dichte umgekehrt proportional zu der Volumen ($V$), was zu folgender Beziehung f hrt:
$p \propto c_n \propto \displaystyle\frac{1}{V}$
In einem Gas, wenn sowohl die Absolute Temperatur ($T$) als auch der Anzahl der Partikel ($N$) konstant gehalten werden, beobachtet man, dass der Volumen ($V$) und die Druck ($p$) sich invers proportional verhalten. Immer wenn der Volumen ($V$) reduziert wird, erh ht sich die Druck ($p$) und umgekehrt,
$p \propto \displaystyle\frac{1}{V}$
wie in der folgenden Grafik dargestellt:
Die Beziehung zwischen der Anzahl der Partikel ($N$) und die Absolute Temperatur ($T$) ist, dass ihr Produkt gleich eine Boyles Gesetzeskonstante ($C_b$) ist, was dem Boyle'schen Gesetz [1] entspricht, benannt nach seinem Entdecker Robert Boyle:
Manchmal sprechen wir ber das Boyle-Mariotte-Gesetz und erinnern uns an den franz sischen Physiker Edme Mariotte, der das gleiche Gesetz 1676 unabh ngig voneinander entdeckte.
![]() [1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Neue physikalisch-mechanische Experimente, die den Federmechanismus der Luft und seine Auswirkungen betreffen), Robert Boyle, Oxford: gedruckt von H. Hall, Drucker der Universit t, f r Tho. Robinson (1660).
[1] "New Experiments Physico-Mechanical, Touching the Spring of the Air, and Its Effects" (Neue physikalisch-mechanische Experimente, die den Federmechanismus der Luft und seine Auswirkungen betreffen), Robert Boyle, Oxford: gedruckt von H. Hall, Drucker der Universit t, f r Tho. Robinson (1660).
Robert Boyle war ein irischer Wissenschaftler, der 1627 geboren wurde. Er gilt als einer der Begr nder der modernen Chemie und ist besonders f r seine Beitr ge zum Verhalten von Gasen bekannt. Die Beziehung zwischen Robert Boyle und dem Boyle'schen Gesetz besteht darin, dass er dieses Gesetz im 17. Jahrhundert formuliert hat. Das Boyle'sche Gesetz besagt, dass bei konstanter Temperatur das Volumen eines Gases umgekehrt proportional zum Druck ist. Boyle f hrte Experimente durch, die diese Beziehung nachwiesen und legte damit den Grundstein f r das Verst ndnis des Gasverhaltens.
Das Boyle'sche Gesetz besagt, dass bei konstanter die Absolute Temperatur ($T$) das Produkt von die Druck ($p$) und der Volumen ($V$) gleich die Boyles Gesetzeskonstante ($C_b$) ist:
Das bedeutet, dass wenn ein Gas von einem Anfangszustand (die Druck im Ausgangszustand ($p_i$) und der Volumen im Zustand i ($V_i$)) in einen Endzustand (die Druck im Endzustand ($p_f$) und der Volumen im Zustand f ($V_f$)) bergeht und dabei die Absolute Temperatur ($T$) konstant bleibt, es immer das Boyle'sche Gesetz erf llen muss:
$p_i V_i = C_b = p_f V_f$
Daher ergibt sich:
Wenn bei einer isothermen nderung, bei der sich der Inhalt nicht ndert, die Druck im Ausgangszustand ($p_i$), die Druck im Endzustand ($p_f$), der Volumen im Zustand i ($V_i$) und der Volumen im Zustand f ($V_f$) durch folgende Gleichung in Beziehung stehen:
Dann kann die Dichte ($\rho$) eingef hrt werden, das zusammen mit die Masse ($M$) und der Volumen ($V$) folgende Bedingung erf llt:
Dies f hrt uns zu die Dichte im Zustand i ($\rho_i$) und die Dichte im Zustand f ($\rho_f$) als:
Das Boyle'sche Gesetz stellt eine Beziehung zwischen der Volumen ($V$) und die Druck ($p$) her und besagt, dass ihr Produkt gleich die Boyles Gesetzeskonstante ($C_b$) ist, wie folgt:
Das Boyle'sche Gesetz stellt eine Beziehung zwischen der Volumen ($V$) und die Druck ($p$) her und besagt, dass ihr Produkt gleich die Boyles Gesetzeskonstante ($C_b$) ist, wie folgt:
Wenn ein Gas von einem Anfangszustand (i) in einen Endzustand (f) bergeht und die Absolute Temperatur ($T$) konstant bleibt, gilt f r die Druck im Ausgangszustand ($p_i$), die Druck im Endzustand ($p_f$), der Volumen im Zustand i ($V_i$) und der Volumen im Zustand f ($V_f$):
Das Boyle'sche Gesetz f r den Anfangszustand (die Dichte im Zustand i ($\rho_i$), die Druck im Ausgangszustand ($p_i$)) und den Endzustand (die Dichte im Zustand f ($\rho_f$), die Druck im Endzustand ($p_f$)) lautet:
ID:(1472, 0)