El Ciclo de Diesel
Storyboard 
El ciclo de Diesel corresponde a un motor de combustión interna en que el calentamiento ocurre a presión constante dejando expandir el gas en el encendiendo la mezcla.
ID:(1487, 0)
El Ciclo de Diesel
Storyboard 
El ciclo de Diesel corresponde a un motor de combustión interna en que el calentamiento ocurre a presión constante dejando expandir el gas en el encendiendo la mezcla.
Variables
Cálculos
Cálculos
Ecuaciones
Siguiendo una analog a al ERROR:5219,0 de l quidos y s lidos con la capacidad calórica ($C$) y la masa ($M$):
existe tambi n un calor específico de gases a volumen constante ($c_V$) para calentamiento bajo volumen constante con la capacidad calórica a volumen constante ($C_V$):
Siguiendo una analog a al ERROR:5219,0 de l quidos y s lidos con la capacidad calórica ($C$) y la masa ($M$):
existe tambi n un calor especifico a presión constante ($c_p$) para calentamiento bajo presi n constante con la capacidad calórica a presión constante ($C_p$):
Al suministrar el calor suministrado ($Q_H$), la temperatura del gas aumenta de $T_2$ a $T_3$ en un proceso isob rico (a presi n constante). Esto implica que podemos utilizar la relaci n para la variación del calor ($\Delta Q$) con la capacidad calórica a presión constante ($C_p$) y la variación de Temperature ($\Delta T$), que se expresa mediante la ecuaci n:
Esto nos lleva a los valores de la temperatura en estado 3 ($T_3$) y la temperatura en estado 2 ($T_2$) mediante la f rmula:
Al retirar el calor absorbido ($Q_C$), la temperatura del gas aumenta de $T_1$ a $T_4$ en un proceso isob rico (a presi n constante). Esto implica que podemos utilizar la relaci n para la variación del calor ($\Delta Q$) con la capacidad calórica a volumen constante ($C_V$) y la variación de Temperature ($\Delta T$), que se expresa mediante la ecuaci n:
Esto nos lleva a los valores de la temperatura en estado 1 ($T_1$) y la temperatura en estado 4 ($T_4$) mediante la f rmula:
Dado que en una expansi n adiab tica, el gas satisface las relaciones el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$) y el indice adiabático ($\kappa$), expresadas como:
Podemos notar que durante el cambio de estado desde el volumen expandido ($V_1$) y la temperatura en estado 1 ($T_1$) a el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$), se cumple la siguiente igualdad:
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
Usando la ecuaci n de el factor de compresibilidad ($r_C$):
Obtenemos:
Dado que en una expansi n adiab tica, el gas cumple con las relaciones el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$) y el indice adiabático ($\kappa$) expresadas como:
Podemos observar que en el cambio de estado desde el volumen intermedio ($V_3$) y la temperatura en estado 3 ($T_3$) a el volumen expandido ($V_1$) y la temperatura en estado 4 ($T_4$), se cumple la siguiente igualdad:
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
Utilizando la ecuaci n de el factor de expansibilidad ($r_E$):
Obtenemos:
Como el calentamiento ocurre a presi n constante, se aplica la ley de Charles que con el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$) es:
Podemos notar que durante el cambio de estado desde el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$) a el volumen intermedio ($V_3$) y la temperatura en estado 3 ($T_3$), se cumple la siguiente igualdad:
$\displaystyle\frac{ T_2 }{ V_2 }=\displaystyle\frac{ T_3 }{ V_3 }$
Usando la ecuaci n de el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$):
podemos escribirlo como:
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
En resumen:
El valor de la eficiencia ($\eta$) se puede calcular utilizando los valores el indice adiabático ($\kappa$), la temperatura en estado 1 ($T_1$), la temperatura en estado 2 ($T_2$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 4 ($T_4$) en la siguiente ecuaci n:
Adem s, las relaciones entre las temperaturas con el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$) est n definidas por las siguientes ecuaciones:
Adicionalmente, se utiliza el valor de el indice adiabático ($\kappa$) en la ecuaci n:
Estas ecuaciones nos permiten calcular el rendimiento de un proceso que sigue el ciclo de Diesel mediante la siguiente ecuaci n:
En una expansi n adiab tica, el gas cumple con la relaci n que involucra el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$):
En este contexto, se pasa del punto inicial 3 al punto 4. Esto implica que durante la expansi n adiab tica, el estado del gas se modifica desde el volumen comprimido ($V_2$) y la temperatura en estado 3 ($T_3$) hasta el volumen expandido ($V_1$) y la temperatura en estado 4 ($T_4$), seg n se establece en:
Dado que en una expansi n adiab tica, el gas satisface la relaci n con el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$):
En este caso, el punto inicial 1 al punto 2. Esto significa que durante la compresi n adiab tica, el estado del gas cambia de el volumen expandido ($V_1$) y la temperatura en estado 1 ($T_1$) a el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$) de acuerdo con:
La eficiencia ($\eta$) es una funci n el calor suministrado ($Q_H$) y el calor absorbido ($Q_C$) seg n:
y las cantidad de el calor suministrado ($Q_H$) con la capacidad calórica a presión constante ($C_p$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 2 ($T_2$) suministrado
y con el calor absorbido ($Q_C$) con la capacidad calórica a volumen constante ($C_V$), la temperatura en estado 4 ($T_4$) y la temperatura en estado 1 ($T_1$) emitiendo
Si se reemplaza ambas expresiones para el calor y se emplea la relaci n de el indice adiabático ($\kappa$):
se obtiene
Ejemplos
El ciclo Diesel es un ciclo termodin mico que fundamenta el funcionamiento de los motores di sel, ampliamente utilizados en veh culos y maquinaria industrial. Desarrollado por Rudolf Diesel en la d cada de 1890, este ciclo se distingue del ciclo Otto de los motores de gasolina principalmente en su proceso de encendido. En el ciclo Diesel, el aire se introduce en el cilindro y se comprime a una relaci n mucho mayor que en los motores de gasolina, lo que eleva su temperatura hasta un punto que puede encender el combustible di sel sin necesidad de una buj a.
Durante el funcionamiento, el ciclo comienza con el pist n atrayendo aire mientras se mueve hacia abajo. Luego, el aire se comprime en el movimiento ascendente, aumentando su temperatura. En el pico de la fase de compresi n, el combustible se inyecta en el aire comprimido y caliente en forma de una fina neblina, causando una ignici n espont nea. La combusti n empuja el pist n hacia abajo, generando energ a. Finalmente, en la fase de escape, los gases de la combusti n se expulsan cuando el pist n se mueve hacia arriba nuevamente, completando el ciclo.
Los motores di sel son reconocidos por su eficiencia y durabilidad. La alta relaci n de compresi n no solo permite que el motor extraiga m s energ a del combustible, sino que tambi n aumenta su eficiencia t rmica, lo que significa que una mayor parte de la energ a del combustible se convierte en trabajo mec nico. Los motores di sel generalmente ofrecen una mejor eficiencia de combustible y producen menos emisiones de CO2 por unidad de energ a que sus contrapartes de gasolina, pero pueden emitir niveles m s altos de otros contaminantes, como xidos de nitr geno y part culas.
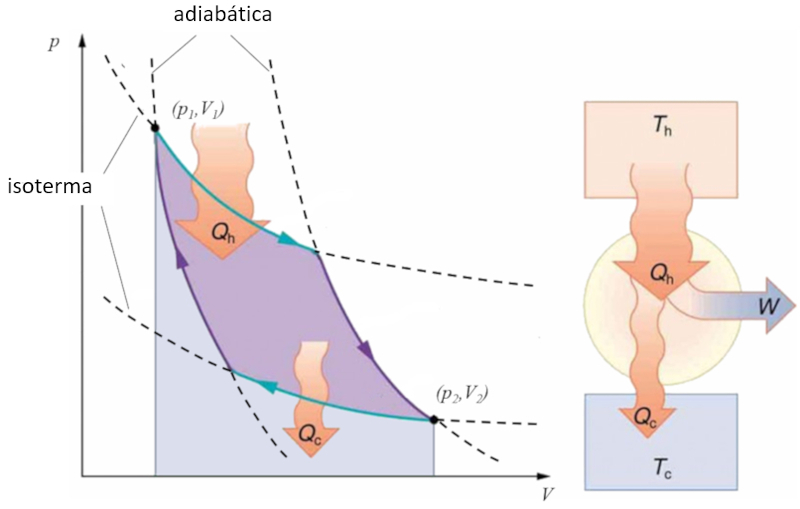
Sadi Carnot introduced [1] the theoretical concept of the first machine design that, based on a heat gradient, can generate mechanical work. This is achieved through a process in the pressure-volume space where heat is added and extracted, as illustrated in the image:
The area under curve el calor suministrado ($Q_H$), spanning from 1 to 2, represents the energy input required to move from the state ($p_1, V_1$) to the state ($p_2, V_2$). The area under curve el calor absorbido ($Q_C$), going from 2 to 1, represents the energy extraction needed to return from the state ($p_2, V_2$) back to the state ($p_1, V_1$). The difference between these areas corresponds to the region enclosed by both curves and represents el trabajo efectivo ($W$) that the system can perform.
Carnot also demonstrated that, due to the second law of thermodynamics, el calor suministrado ($Q_H$) cannot be zero, implying that there are no machines capable of converting all heat into work.
![]() [1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexiones sobre la fuerza motriz del fuego y sobre las m quinas preparadas para desarrollar esa fuerza), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
[1] "R flexions sur la puissance motrice du feu et sur les machines propres d velopper cette puissance" (Reflexiones sobre la fuerza motriz del fuego y sobre las m quinas preparadas para desarrollar esa fuerza), Sadi Carnot, Annales scientifiques de l .N.S. 2e s rie, tome 1, p. 393-457 (1872)
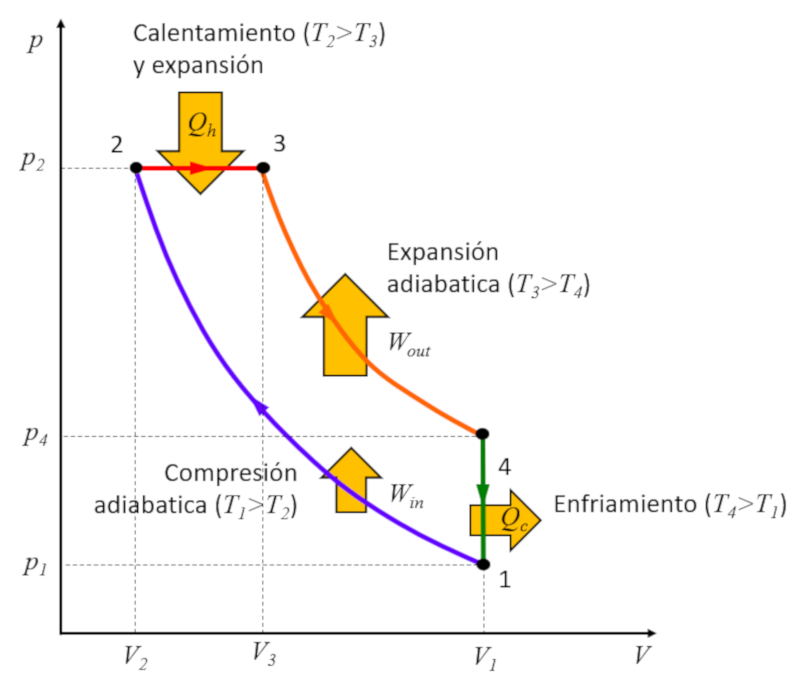
Rudolf Diesel [1] se propuso crear un ciclo diferente al ciclo de Carnot con el objetivo de lograr una eficiencia superior en comparaci n con el ciclo de Otto. Este proceso se desarrolla en las siguientes etapas:
• Etapa 1 a 2: Compresi n adiab tica $(p_1,V_1,T_1)\rightarrow (p_2,V_2,T_2)$,
• Etapa 2 a 3: Calentamiento y expansi n a presi n constante $(p_2,V_2,T_2)\rightarrow (p_2,V_3,T_3)$,
• Etapa 3 a 4: Expansi n adiab tica $(p_2,V_3,T_3)\rightarrow (p_3,V_1,T_4)$,
• Etapa 4 a 1: Enfriamiento a volumen constante $(p_3,V_1,T_4)\rightarrow (p_1,V_1,T_1)$
Estas etapas se ilustran a continuaci n:
La clave se encuentra en la etapa 2 a 3, donde la expansi n ocurre a presi n constante. La raz n se hace evidente al examinar el gr fico:
La energ a ganada es igual al rea encerrada dentro del ciclo, y al realizar la compresi n a presi n constante, esta rea es mayor que en el caso de la compresi n a volumen constante.
![]() [1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M todo para el desarrollo de un motor t rmico racional que reemplace el motor de vapor y los motores de combusti n contempor neos), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
[1] "Verfahren zur Entwickelung eines rationellen W rmemotors zum Ersatz der Dampfmaschine und der heute bekannten Verbrennungsmotoren" (M todo para el desarrollo de un motor t rmico racional que reemplace el motor de vapor y los motores de combusti n contempor neos), Rudolf Diesel, Kaiserlichen Patentamts, No. 67207 (1892)
Tanto el ciclo de Otto como el ciclo de Diesel dependen de la temperatura en estado 1 ($T_1$), la temperatura en estado 2 ($T_2$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 4 ($T_4$). Sin embargo, en el caso del ciclo de Diesel, tambi n depende de el indice adiabático ($\kappa$), cuyo valor es de 1.4.
En el caso del ciclo de Otto, la eficiencia se calcula en funci n de la temperatura utilizando la ecuaci n:
Mientras que en el ciclo de Diesel, la eficiencia se calcula en funci n de la temperatura utilizando la ecuaci n:
La inclusi n del factor $1/\kappa \sim 0.71$ en el ciclo de Diesel lo hace m s eficiente en comparaci n con el ciclo de Otto para la misma configuraci n de temperaturas. Esto es la consecuencia directa de haber logrado aumentar el rea encerrada en la curva que representa el ciclo en la representaci n presi n y volumen.
Dado que en una expansi n adiab tica, el gas cumple con las relaciones el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$) y el indice adiabático ($\kappa$) expresadas como:
Podemos observar que en el cambio de estado desde el volumen intermedio ($V_3$) y la temperatura en estado 3 ($T_3$) a el volumen expandido ($V_1$) y la temperatura en estado 4 ($T_4$), se cumple la siguiente igualdad:
$T_3V_3^{\kappa-1}=T_4V_1^{\kappa-1}$
Utilizando la ecuaci n de el factor de expansibilidad ($r_E$):
Obtenemos:
Dado que en una expansi n adiab tica, el gas satisface las relaciones el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$), la temperatura en estado final ($T_f$) y el indice adiabático ($\kappa$), expresadas como:
Podemos notar que durante el cambio de estado desde el volumen expandido ($V_1$) y la temperatura en estado 1 ($T_1$) a el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$), se cumple la siguiente igualdad:
$T_1V_1^{\kappa-1}=T_2V_2^{\kappa-1}$
Usando la ecuaci n de el factor de compresibilidad ($r_C$):
Obtenemos:
Como el calentamiento ocurre a presi n constante, se aplica la ley de Charles que con el volumen en estado i ($V_i$), el volumen en estado f ($V_f$), la temperatura en estado inicial ($T_i$) y la temperatura en estado final ($T_f$) es:
Podemos notar que durante el cambio de estado desde el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$) a el volumen intermedio ($V_3$) y la temperatura en estado 3 ($T_3$), se cumple la siguiente igualdad:
$\displaystyle\frac{ T_2 }{ V_2 }=\displaystyle\frac{ T_3 }{ V_3 }$
Usando la ecuaci n de el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$):
podemos escribirlo como:
$T_3 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_2} T_2 = \displaystyle\frac{V_3}{V_1} \displaystyle\frac{V_1}{V_2} T_2 = \displaystyle\frac{r_C}{r_E} T_2$
En resumen:
La eficiencia ($\eta$) es una funci n el calor suministrado ($Q_H$) y el calor absorbido ($Q_C$) seg n:
y las cantidad de el calor suministrado ($Q_H$) con la capacidad calórica a presión constante ($C_p$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 2 ($T_2$) suministrado
y con el calor absorbido ($Q_C$) con la capacidad calórica a volumen constante ($C_V$), la temperatura en estado 4 ($T_4$) y la temperatura en estado 1 ($T_1$) emitiendo
Si se reemplaza ambas expresiones para el calor y se emplea la relaci n de el indice adiabático ($\kappa$):
se obtiene
El valor de la eficiencia ($\eta$) se puede calcular utilizando los valores el indice adiabático ($\kappa$), la temperatura en estado 1 ($T_1$), la temperatura en estado 2 ($T_2$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 4 ($T_4$) en la siguiente ecuaci n:
Adem s, las relaciones entre las temperaturas con el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$) est n definidas por las siguientes ecuaciones:
Adicionalmente, se utiliza el valor de el indice adiabático ($\kappa$) en la ecuaci n:
Estas ecuaciones nos permiten calcular el rendimiento de un proceso que sigue el ciclo de Diesel mediante la siguiente ecuaci n:
En este caso, el punto inicial 1 al punto 2. Esto significa que durante la compresi n adiab tica, el estado del gas cambia de el volumen expandido ($V_1$) y la temperatura en estado 1 ($T_1$) a el volumen comprimido ($V_2$) y la temperatura en estado 2 ($T_2$) de acuerdo con:
El calor suministrado ($Q_H$) se puede calcular con la capacidad calórica a presión constante ($C_p$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 2 ($T_2$) mediante la f rmula:
En este contexto, se pasa del punto inicial 3 al punto 4. Esto implica que durante la expansi n adiab tica, el estado del gas se modifica desde el volumen comprimido ($V_2$) y la temperatura en estado 3 ($T_3$) hasta el volumen expandido ($V_1$) y la temperatura en estado 4 ($T_4$), seg n se establece en:
El calor absorbido ($Q_C$) se puede calcular de la capacidad calórica a volumen constante ($C_V$), la temperatura en estado 4 ($T_4$) y la temperatura en estado 1 ($T_1$) mediante la f rmula:
En el an lisis del ciclo Diesel, resulta beneficioso introducir el t rmino el factor de compresibilidad ($r_C$), el cual representa la relaci n entre el volumen expandido ($V_1$) y el volumen comprimido ($V_2$) durante la compresi n de la mezcla, tal como se ilustra en la siguiente expresi n:
En el an lisis del ciclo Diesel, resulta provechoso incorporar el concepto el factor de expansibilidad ($r_E$), que representa la relaci n entre el volumen expandido ($V_1$) y el volumen intermedio ($V_3$) durante la compresi n de la mezcla, tal como se muestra en la siguiente expresi n:
La temperatura en estado 3 ($T_3$) se puede calcular con la temperatura en estado 4 ($T_4$), el factor de expansibilidad ($r_E$) y el indice adiabático ($\kappa$) mediante:
La temperatura en estado 2 ($T_2$) se puede calcular de la temperatura en estado 1 ($T_1$), el factor de compresibilidad ($r_C$) y el indice adiabático ($\kappa$) mediante:
La temperatura en estado 3 ($T_3$) se puede calcular de la temperatura en estado 2 ($T_2$), el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$) mediante:
La eficiencia ($\eta$) se puede calcular de el indice adiabático ($\kappa$), la temperatura en estado 1 ($T_1$), la temperatura en estado 2 ($T_2$), la temperatura en estado 3 ($T_3$) y la temperatura en estado 4 ($T_4$) mediante:
El c lculo de la eficiencia ($\eta$) se realiza utilizando el indice adiabático ($\kappa$), el factor de compresibilidad ($r_C$) y el factor de expansibilidad ($r_E$), de la siguiente manera:
El calor especifico a presión constante ($c_p$) es igual a la capacidad calórica a presión constante ($C_p$) dividido por la masa ($M$):
El calor específico de gases a volumen constante ($c_V$) es igual a la capacidad calórica a volumen constante ($C_V$) dividido por la masa ($M$):
ID:(1487, 0)