Aplicación a Gas de Van der Waals
Storyboard 
La ecuación de estado de Van der Waals tiene la peculiaridad de describir estados que no son estables. Un análisis mas detallado muestran que representan la fase liquida del sistema. Su estudio muestra como se puede emplear la energía libre de Gibbs para entender un sistema de dos fases.Como referencia se puede consultar el articulo Thermodynamic Properties of the van der Waals Fluid de David C. Johnston.
ID:(556, 0)
Gas de Van der Waals y cambio de fase
Descripción 
Dado que el mínimo de la energía de Gibbs requiere de que la compresibilidad sea positiva con
| $\left(\displaystyle\frac{\partial^2 G_0}{\partial V^2}\right)_T=-\left(\displaystyle\frac{\partial\bar{p}}{\partial V}\right)_T$ |
se concluye que al ser con
| $ k_p =-\displaystyle\frac{ DV_{p,T} }{ V }$ |
\\n\\nla ecuación de Van der Waals muestra una inestable en la sección en que\\n\\n
$\displaystyle\frac{\partial p}{\partial V}> 0$
La región inestable separa una región de gran volumen molar y de alta compresibilidad, como en un gas, de una región de bajo volumen molar y baja compresibilidad, como en un liquido. Por ello se visualiza que la ecuación de Van der Waals podría representar un gas pero también, en condiciones apropiadas, un liquido. El sector de inestabilidad estaría relacionado con el cambio de fase.
ID:(9044, 0)
Cambio de fase con el modelo de Van Der Waals
Imagen 
Para comprender como se comporta el sistema en la zona en que la pendiente presión volumen es positiva debemos estudiar la curva volumen temperatura entre las presión
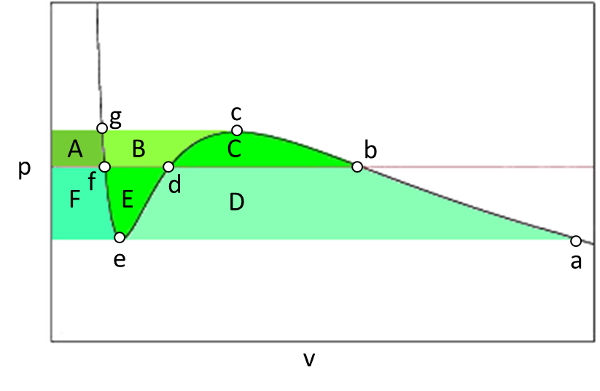
\\n\\nFunción de Gibbs para el gas de Van Der Waals\\n\\nEn esta gráfica podemos ir calculando las energías de Gibbs que se van dando en los distintos puntos a hasta g de la curva. Así tenemos que inicialmente la energía de Gibbs crece del punto a, al b y al c:\\n\\n
$g_b = g_a + D + E + F$
\\n\\n
$g_c = g_b + A + B + C = g_a + D + E + F + A + B + C$
\\n\\nA partir del punto c va decreciendo hasta el punto d y luego e\\n\\n
$g_d = g_b - A - B = g_a + D + E + F + C$
\\n\\n
$g_e = g_d - E - F = g_a + D + C$
\\n\\nFinalmente vuelve a crecer hasta el punto f y luego g\\n\\n
$g_f = g_e + F = g_a + D + C + F$
\\n\\n
$g_g = g_f + A = g_a + D + C + F + A$
ID:(1979, 0)
Función de Gibbs en función de la presión
Imagen 
Si se grafican los puntos a hasta f notaremos que la función tiene tres segmentos:
• inicial creciente entre a y c hasta un máximo de $g_c = g_a + A + B + C + D + E + F$
• decreciente entre c y e hasta un valor de $g_e = g_a + C + D < g_c$
• nuevamente creciente entre e y g hasta un valor de $g_g = g_a + A + F + C + D < g_c$
Al ser
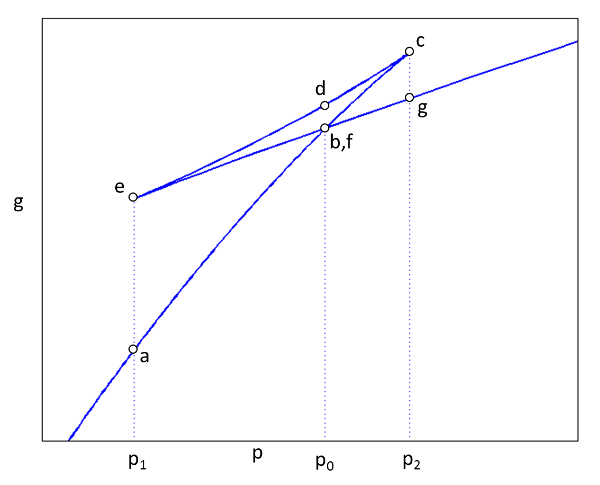
\\n\\nEn ese caso se tendría que\\n\\n
$g_b = g_f$
lo que lleva a que las áreas C y E deben ser iguales. Como el sistema en equilibro siempre tendrá una energía libre de Gibbs mínima, se concluye que el sistema tiene que permanecer en el punto de intersección o sea pasa directamente del punto b al punto f o viceversa.
ID:(1994, 0)
Constantes de Van der Waals
Descripción 
Las siguientes constantes de la ecuación de Van der Waals:En Sistema Internacional (SI)Compuesto | a (J m3/mol2) | b (10-3 m3/mol)----------------|:------------------:|:---------------------:Ácido acético | 1.782 | 0.1068Anhídrido acético | 2.016 | 0.1263Acetona | 1.409 | 0.0994Acetonitrilo | 1.781 | 0.1168Acetileno | 0.445 | 0.05136Amoníaco | 0.423 | 0.03707Argón | 0.136 | 0.03219Benceno | 1.824 | 0.1154Bromobenceno | 2.894 | 0.1539Butano | 1.466 | 0.1226Dióxido de carbono | 0.364 | 0.04267Sulfuro de carbono | 1.177 | 0.07685Monóxido de carbono | 0.151 | 0.03985Cloruro de carbono (IV) | 1.975 | 0.1281Cloro | 0.658 | 0.05622Clorobenceno | 2.577 | 0.1453Cloroetano | 1.105 | 0.08651Clorometano | 0.757 | 0.06483Cianógeno | 0.777 | 0.06901Ciclohexano | 2.311 | 0.1424Éter dietílico | 1.761 | 0.1344Sulfuro de dietilo | 1.900 | 0.1214Éter de dimetilo | 0.818 | 0.07246Sulfuro de dimetilo | 1.304 | 0.09213Etano | 0.556 | 0.0638Etanotiol | 1.139 | 0.08098Etanol | 1.218 | 0.08407Acetato de etilo | 2.072 | 0.1412Etilamina | 1.074 | 0.08409Fluorobenceno | 2.019 | 0.1286Fluorometano | 0.469 | 0.05264Freón | 1.078 | 0.0998Tetracloruro de germanio | 2.290 | 0.1485Helio | 0.0035 | 0.0237Hexano | 2.471 | 0.1735Hidrógeno | 0.0248 | 0.02661Bromuro de hidrógeno | 0.4510 | 0.04431Cloruro de hidrógeno | 0.372 | 0.04081Seleniuro de hidrógeno | 0.534 | 0.04637Sulfuro de hidrógeno | 0.449 | 0.04287Iodobenceno | 3.352 | 0.1656Kriptón | 0.235 | 0.03978Mercurio | 0.820 | 0.01696Metano | 0.228 | 0.04278Metanol | 0.965 | 0.06702Neón | 0.0213 | 0.01709Óxido nítrico | 0.1358 | 0.02789Nitrógeno | 0.1408 | 0.03913Dióxido de nitrógeno | 0.5354 | 0.04424Óxido nitroso | 0.3832 | 0.04415Oxígeno | 0.1378 | 0.03183Pentano | 1.926 | 0.146Fosfina | 0.4692 | 0.05156Propano | 0.8779 | 0.08445Silano | 0.4377 | 0.05786Tetrafluoruro de silicio | 0.4251 | 0.05571Dióxido de azufre | 0.6803 | 0.05636Cloruro de estaño | 2.727 | 0.1642Tolueno | 2.438 | 0.1463Agua | 0.5536 | 0.03049Xenón | 0.4250 | 0.05105
ID:(9648, 0)
Representación gráfica ecuación de Van der Waals
Descripción 
La ecuación de Van der Waals presenta un área de menores temperaturas en que existe una situación en que\\n\\n
$\displaystyle\frac{\partial p}{\partial V}\geq 0$
que representa un estado inestable. La pregunta es como se comporta el sistema en esta sección de la curva para lo que se debe recordar que en todo momento la energía de Gibbs debe ser un mínimo con :
| $ \Delta G_0 =\mbox{minimo}$ |
Por ello debemos representar la energía de Gibbs
ID:(864, 0)
Aplicación a Gas de Van der Waals
Modelo 
La ecuación de estado de Van der Waals tiene la peculiaridad de describir estados que no son estables. Un análisis mas detallado muestran que representan la fase liquida del sistema. Su estudio muestra como se puede emplear la energía libre de Gibbs para entender un sistema de dos fases.\\n\\nComo referencia se puede consultar el articulo Thermodynamic Properties of the van der Waals Fluid de David C. Johnston.
Variables
Cálculos
Cálculos
Ecuaciones
Ejemplos
Dado que el m nimo de la energ a de Gibbs requiere de que la compresibilidad sea positiva con
| $\left(\displaystyle\frac{\partial^2 G_0}{\partial V^2}\right)_T=-\left(\displaystyle\frac{\partial\bar{p}}{\partial V}\right)_T$ |
se concluye que al ser con
| $ k_p =-\displaystyle\frac{ DV_{p,T} }{ V }$ |
\\n\\nla ecuaci n de Van der Waals muestra una inestable en la secci n en que\\n\\n
$\displaystyle\frac{\partial p}{\partial V}> 0$
La regi n inestable separa una regi n de gran volumen molar y de alta compresibilidad, como en un gas, de una regi n de bajo volumen molar y baja compresibilidad, como en un liquido. Por ello se visualiza que la ecuaci n de Van der Waals podr a representar un gas pero tambi n, en condiciones apropiadas, un liquido. El sector de inestabilidad estar a relacionado con el cambio de fase.
(ID 9044)
Para comprender como se comporta el sistema en la zona en que la pendiente presi n volumen es positiva debemos estudiar la curva volumen temperatura entre las presi n

\\n\\nFunci n de Gibbs para el gas de Van Der Waals\\n\\nEn esta gr fica podemos ir calculando las energ as de Gibbs que se van dando en los distintos puntos a hasta g de la curva. As tenemos que inicialmente la energ a de Gibbs crece del punto a, al b y al c:\\n\\n
$g_b = g_a + D + E + F$
\\n\\n
$g_c = g_b + A + B + C = g_a + D + E + F + A + B + C$
\\n\\nA partir del punto c va decreciendo hasta el punto d y luego e\\n\\n
$g_d = g_b - A - B = g_a + D + E + F + C$
\\n\\n
$g_e = g_d - E - F = g_a + D + C$
\\n\\nFinalmente vuelve a crecer hasta el punto f y luego g\\n\\n
$g_f = g_e + F = g_a + D + C + F$
\\n\\n
$g_g = g_f + A = g_a + D + C + F + A$
(ID 1979)
Si se grafican los puntos a hasta f notaremos que la funci n tiene tres segmentos:
• inicial creciente entre a y c hasta un m ximo de $g_c = g_a + A + B + C + D + E + F$
• decreciente entre c y e hasta un valor de $g_e = g_a + C + D < g_c$
• nuevamente creciente entre e y g hasta un valor de $g_g = g_a + A + F + C + D < g_c$
Al ser

\\n\\nEn ese caso se tendr a que\\n\\n
$g_b = g_f$
lo que lleva a que las reas C y E deben ser iguales. Como el sistema en equilibro siempre tendr una energ a libre de Gibbs m nima, se concluye que el sistema tiene que permanecer en el punto de intersecci n o sea pasa directamente del punto b al punto f o viceversa.
(ID 1994)
Las siguientes constantes de la ecuaci n de Van der Waals:En Sistema Internacional (SI)Compuesto | a (J m3/mol2) | b (10-3 m3/mol)----------------|:------------------:|:---------------------: cido ac tico | 1.782 | 0.1068Anh drido ac tico | 2.016 | 0.1263Acetona | 1.409 | 0.0994Acetonitrilo | 1.781 | 0.1168Acetileno | 0.445 | 0.05136Amon aco | 0.423 | 0.03707Arg n | 0.136 | 0.03219Benceno | 1.824 | 0.1154Bromobenceno | 2.894 | 0.1539Butano | 1.466 | 0.1226Di xido de carbono | 0.364 | 0.04267Sulfuro de carbono | 1.177 | 0.07685Mon xido de carbono | 0.151 | 0.03985Cloruro de carbono (IV) | 1.975 | 0.1281Cloro | 0.658 | 0.05622Clorobenceno | 2.577 | 0.1453Cloroetano | 1.105 | 0.08651Clorometano | 0.757 | 0.06483Cian geno | 0.777 | 0.06901Ciclohexano | 2.311 | 0.1424 ter diet lico | 1.761 | 0.1344Sulfuro de dietilo | 1.900 | 0.1214 ter de dimetilo | 0.818 | 0.07246Sulfuro de dimetilo | 1.304 | 0.09213Etano | 0.556 | 0.0638Etanotiol | 1.139 | 0.08098Etanol | 1.218 | 0.08407Acetato de etilo | 2.072 | 0.1412Etilamina | 1.074 | 0.08409Fluorobenceno | 2.019 | 0.1286Fluorometano | 0.469 | 0.05264Fre n | 1.078 | 0.0998Tetracloruro de germanio | 2.290 | 0.1485Helio | 0.0035 | 0.0237Hexano | 2.471 | 0.1735Hidr geno | 0.0248 | 0.02661Bromuro de hidr geno | 0.4510 | 0.04431Cloruro de hidr geno | 0.372 | 0.04081Seleniuro de hidr geno | 0.534 | 0.04637Sulfuro de hidr geno | 0.449 | 0.04287Iodobenceno | 3.352 | 0.1656Kript n | 0.235 | 0.03978Mercurio | 0.820 | 0.01696Metano | 0.228 | 0.04278Metanol | 0.965 | 0.06702Ne n | 0.0213 | 0.01709 xido n trico | 0.1358 | 0.02789Nitr geno | 0.1408 | 0.03913Di xido de nitr geno | 0.5354 | 0.04424 xido nitroso | 0.3832 | 0.04415Ox geno | 0.1378 | 0.03183Pentano | 1.926 | 0.146Fosfina | 0.4692 | 0.05156Propano | 0.8779 | 0.08445Silano | 0.4377 | 0.05786Tetrafluoruro de silicio | 0.4251 | 0.05571Di xido de azufre | 0.6803 | 0.05636Cloruro de esta o | 2.727 | 0.1642Tolueno | 2.438 | 0.1463Agua | 0.5536 | 0.03049Xen n | 0.4250 | 0.05105
(ID 9648)
La ecuaci n de Van der Waals presenta un rea de menores temperaturas en que existe una situaci n en que\\n\\n
$\displaystyle\frac{\partial p}{\partial V}\geq 0$
que representa un estado inestable. La pregunta es como se comporta el sistema en esta secci n de la curva para lo que se debe recordar que en todo momento la energ a de Gibbs debe ser un m nimo con :
| $ \Delta G_0 =\mbox{minimo}$ |
Por ello debemos representar la energ a de Gibbs
(ID 864)
ID:(556, 0)
