Comportamiento en la línea de equilibrio entre fases
Definición 
Si se estudian las fases de un sistema (solido, liquido, gas) bajo distintas presiones y temperaturas se notara que existen zonas claramente delimitadas de estados definidas por lineas en que conviven dos estados. Estas lineas se definen como relaciones entre la presión y temperatura y parecen en primera aproximación ser relaciones lineales:

Existe ademas un punto en que las tres fases existen simultáneamente. Dicho punto se denomina el punto triple. Existe ademas un segundo punto llamado punto critico en que la diferenciación entre gas y liquido se pierde no existiendo una separación definida ni energías que se asocien a convertir una en la otra.
ID:(837, 0)
Diagrama de fase en general
Imagen 
El cambio de fase se diagrama en lo que se denomina un diagrama de fase.
En materiales puros el diagrama se caracteriza por tener tres zonas que corresponden a la fase solida, liquida y gaseosa.

Las lineas dibujadas corresponde a las combinaciones entre presión y temperatura en que cada vez dos fases pueden coexistir. Cada vez que se varia la temperatura y/o la presión de modo de atravesar una linea divisoria el sistema absorbe (paso solido a liquido/gas o paso liquido a gas) energía mientras que en el caso inverso la entrega (gas a liquido/solido o liquido a solido).
Adicionalmente se diagrama el llamado 'punto triple' marcando la combinación entre presión y temperatura que permite que las tres faces coexistan simultáneamente.
El punto critico marca el limite sobre el cual la fase liquida y gaseosas sin indistinguibles, es decir no existe una energía que marque el paso de una fase a la otra por lo que la propia diferenciación conceptual carece de sentido.
Si se estudia el comportamiento de la fase solida se va a descubrir que existen muchas veces distintas formas en que el material cristaliza lo que lleva a que la fase solida esta en realidad compuesta de una serie de fases solidas pero de distinta estructura. En este caso también existen lineas divisorias en que se marcan estados en que una o mas fases pueden coexistir y la transición entrega o absorbe energía.
El diagrama de fase también es empelado para describir materiales con impurezas que contribuyen a cambios importantes en las propiedades de los materiales. Esto es típico en metales que incluyen pequeñas cantidades de materiales como el aluminio, cobre, cromo, etc.. Existen así distintas fases de cristalización y cada una es descrita como una fase distinta.
ID:(834, 0)
Diagrama de fase del agua
Nota 
Uno de los diagramas de fase más significativos para nuestro planeta es el del agua. Este diagrama presenta las tres fases clásicas: sólido, líquido y gas, además de una variedad de fases con diferentes estructuras cristalinas del hielo.
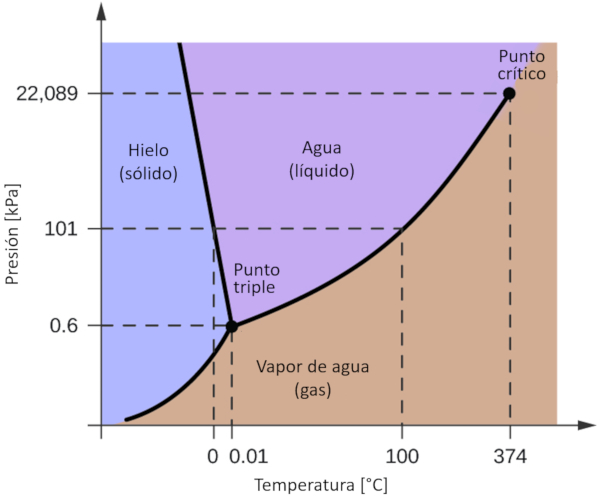
La característica más destacada en comparación con otros materiales es que en un rango de presión comprendido entre 611 Pa y 209.9 MPa, el estado sólido ocupa un volumen mayor que el estado líquido. Este fenómeno se refleja en el diagrama de fase como una pendiente negativa en la línea que separa las fases sólidas (hielo con estructura hexagonal) y líquidas (agua).
ID:(836, 0)
Ecuación de Clausius-Clapeyron
Storyboard 
Variables
Cálculos
Cálculos
Ecuaciones
Si el sistema consta de
$n=n_1+n_2$
\\n\\nsin embargo, como el sistema se considera cerrado, todo cambio no variara el numero total de moles:\\n\\n
$dn=dn_1+dn_2=0$
\\n\\nSi la energ a libre de Gibbs por mol del sistema en la fase 1 es
$G=n_1g_1+n_2g_2$
\\n\\nComo la energ a libre por mol depende de la presi n, temperatura y tipo de fase se tendr que una variaci n ser igual a\\n\\n
$dG=g_1dn_1+g_2dn_2=0$
\\n\\nPor ello, con la condici n de que
$(g_1-g_2)dn_1=0$
por lo que las funciones de Gibbs de ambas fases deben ser iguales por lo que con
La energ a libre de Gibbs por mol para la fase
$g_i=u_i-Ts_i+pv_i$
\\n\\ncon
$dg_i=du_i-s_idT-Tds_i+pdv_i+v_idp$
\\n\\nCon la primera ley de la termodin mica\\n\\n
$du_i=Tds_i-pdv_i$
\\n\\nse tiene que\\n\\n
$dg_i=-s_idT+v_idp$
\\n\\nAl ser las energ as libres de Gibbs por mol iguales se tiene que tambi n lo deben ser la variaciones de estas por lo que\\n\\n
$dg_1=-s_1dT+v_1dp=-s_2dT+v_2dp=dg_2$
\\n\\nlo que se puede escribir como\\n\\n
$(s_2-s_1)dT=(v_2-v_1)dp$
o con las diferencias
Como la variaci n de la entrop a por mol al paso de una fase a otra es
la ecuaci n de Clausius Clapeyron
se puede tambi n escribir como
Ejemplos
Si se estudian las fases de un sistema (solido, liquido, gas) bajo distintas presiones y temperaturas se notara que existen zonas claramente delimitadas de estados definidas por lineas en que conviven dos estados. Estas lineas se definen como relaciones entre la presi n y temperatura y parecen en primera aproximaci n ser relaciones lineales:
Existe ademas un punto en que las tres fases existen simult neamente. Dicho punto se denomina el punto triple. Existe ademas un segundo punto llamado punto critico en que la diferenciaci n entre gas y liquido se pierde no existiendo una separaci n definida ni energ as que se asocien a convertir una en la otra.
Si se tiene un sistema
Si se asume que en el proceso de cambio de fase la energ a libre de Gibbs permanece constante se tiene que sus variaciones deben ser iguales\\n\\n
$dg_1=-s_1dT+v_1dp=-s_2dT+v_2dp=dg_2$
por lo que se puede mostrar que la presi n variara en la temperatura como
El cambio de fase se diagrama en lo que se denomina un diagrama de fase.
En materiales puros el diagrama se caracteriza por tener tres zonas que corresponden a la fase solida, liquida y gaseosa.
Las lineas dibujadas corresponde a las combinaciones entre presi n y temperatura en que cada vez dos fases pueden coexistir. Cada vez que se varia la temperatura y/o la presi n de modo de atravesar una linea divisoria el sistema absorbe (paso solido a liquido/gas o paso liquido a gas) energ a mientras que en el caso inverso la entrega (gas a liquido/solido o liquido a solido).
Adicionalmente se diagrama el llamado 'punto triple' marcando la combinaci n entre presi n y temperatura que permite que las tres faces coexistan simult neamente.
El punto critico marca el limite sobre el cual la fase liquida y gaseosas sin indistinguibles, es decir no existe una energ a que marque el paso de una fase a la otra por lo que la propia diferenciaci n conceptual carece de sentido.
Si se estudia el comportamiento de la fase solida se va a descubrir que existen muchas veces distintas formas en que el material cristaliza lo que lleva a que la fase solida esta en realidad compuesta de una serie de fases solidas pero de distinta estructura. En este caso tambi n existen lineas divisorias en que se marcan estados en que una o mas fases pueden coexistir y la transici n entrega o absorbe energ a.
El diagrama de fase tambi n es empelado para describir materiales con impurezas que contribuyen a cambios importantes en las propiedades de los materiales. Esto es t pico en metales que incluyen peque as cantidades de materiales como el aluminio, cobre, cromo, etc.. Existen as distintas fases de cristalizaci n y cada una es descrita como una fase distinta.
Uno de los diagramas de fase m s significativos para nuestro planeta es el del agua. Este diagrama presenta las tres fases cl sicas: s lido, l quido y gas, adem s de una variedad de fases con diferentes estructuras cristalinas del hielo.
La caracter stica m s destacada en comparaci n con otros materiales es que en un rango de presi n comprendido entre 611 Pa y 209.9 MPa, el estado s lido ocupa un volumen mayor que el estado l quido. Este fen meno se refleja en el diagrama de fase como una pendiente negativa en la l nea que separa las fases s lidas (hielo con estructura hexagonal) y l quidas (agua).
La diferencia de entropias
Como la variaci n de la entrop a por mol al paso de una fase a otra se puede reescribir la ecuaci n de Clausius Clapeyron como
ID:(546, 0)
