Erster Hauptsatz der Thermodynamik
Storyboard 
Das erste Gesetz der Thermodynamik besagt, dass Energie erhalten bleibt und sich aus zwei Komponenten zusammensetzt: einer, die mit Arbeit verbunden ist, und einer anderen, die mit Wärme verbunden ist. Im Gegensatz zur Arbeit kann dieser letztere Teil nicht vollständig in Arbeit umgewandelt werden, was die möglichen Energieumwandlungen einschränkt.
ID:(1398, 0)
Mechanismen
Konzept 
Das erste Gesetz der Thermodynamik, auch als Gesetz der Energieerhaltung bekannt, besagt, dass Energie in einem isolierten System weder erschaffen noch zerstört werden kann; sie kann nur übertragen oder umgewandelt werden. Dieses Prinzip besagt, dass die Gesamtenergie eines isolierten Systems konstant bleibt. In praktischen Begriffen bedeutet dies, dass die Änderung der inneren Energie eines Systems gleich der hinzugefügten Wärme abzüglich der vom System geleisteten Arbeit ist. Die innere Energie umfasst die gesamte Energie innerhalb eines Systems, einschließlich der kinetischen und potenziellen Energie auf molekularer Ebene. Wärme ist die Energie, die zwischen Systemen aufgrund eines Temperaturunterschieds übertragen wird, während Arbeit die Energie ist, die übertragen wird, wenn eine Kraft über eine Strecke ausgeübt wird, oft in Zusammenhang mit Volumenänderungen in Gasen. Das erste Gesetz ist grundlegend für die Analyse der Effizienz von Wärmekraftmaschinen, die Leistung von Kühl- und Heizsystemen und das Verständnis von Stoffwechselprozessen in biologischen Systemen. Es bildet die Grundlage für das Verständnis von Energieübertragungen und -umwandlungen in verschiedenen physikalischen Prozessen und stellt sicher, dass die Energie innerhalb eines isolierten Systems immer erhalten bleibt.
ID:(15250, 0)
Energieeinsparung
Konzept 
Das erste Gesetz der Thermodynamik besagt, dass Energie immer erhalten bleibt.Während in der Mechanik eine ähnliche Erhaltung formuliert wird, die auf nicht dissipative Systeme beschränkt ist (zum Beispiel unter Ausschluss von Reibung), generalisiert die Thermodynamik dies, indem sie nicht nur die mechanische Arbeit, sondern auch die vom System erzeugte oder absorbierte Wärme berücksichtigt.In diesem Sinne gibt es keine Einschränkungen für die in der Thermodynamik postulierte Energieerhaltung und sie gilt für alle Systeme, solange alle möglichen Energieaustausche und -umwandlungen berücksichtigt werden.
ID:(37, 0)
Ersten Hauptsatzes der Thermodynamik
Konzept 
Das erste Gesetz der Thermodynamik wurde durch verschiedene Arbeiten [1,2] entwickelt und besagt, dass Energie erhalten bleibt. Das bedeutet, dass der Interne Energiedifferenz ($dU$) immer gleich der Differential ungenau Wärme ($\delta Q$) ist, das dem System zugeführt wird (positiv), abzüglich der Differential ungenaue Arbeits ($\delta W$), das vom System geleistet wird (negativ).
Daher haben wir:
| $ dU = \delta Q - \delta W $ |
Während das exakte Differential nicht davon abhängt, wie die Variation ausgeführt wird, hängt das inexakte Differential davon ab. Wenn wir uns auf ein Differential beziehen, ohne anzugeben, dass es inexact ist, wird angenommen, dass es exakt ist.![]() [1] "Über die quantitative und qualitative Bestimmung der Kräfte", Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842
[1] "Über die quantitative und qualitative Bestimmung der Kräfte", Julius Robert von Mayer, Annalen der Chemie und Pharmacie, 1842![]() [2] "Über die Erhaltung der Kraft", Hermann von Helmholtz, 1847
[2] "Über die Erhaltung der Kraft", Hermann von Helmholtz, 1847
ID:(15700, 0)
Druck und Arbeit
Beschreibung 
Betrachten wir ein Gas in einem Zylinder, in dem sich ein Kolben bewegen kann. Wenn der Kolben bewegt wird, kann das Gasvolumen durch Kompression verringert werden. Für diese Kompression wird Energie benötigt, die gleich der vom Gas ausgeübten Kraft multipliziert mit der zurückgelegten Strecke des Kolbens ist. Diese Energie kann auch in Bezug auf den Druck dargestellt werden, da Druck durch die Kraft und den Querschnitt des Kolbens definiert wird.
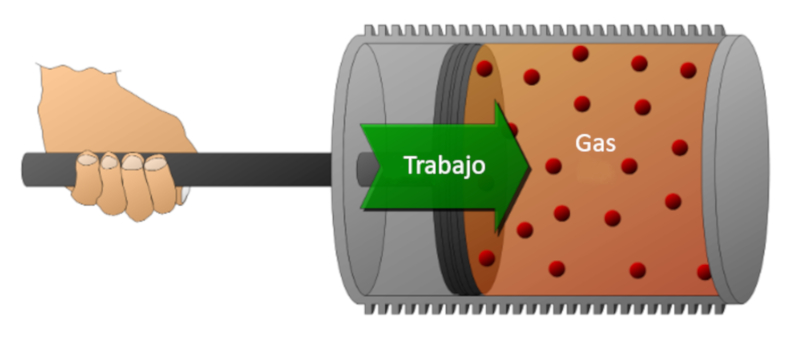
Arbeit kann am System geleistet werden (Kompression) oder vom System auf die externe Umgebung übertragen werden (Expansion).
Da die Mechanische Kraft ($F$) geteilt durch die Abschnitt ($S$) gleich die Druck ($p$) ist:
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
und die Volumenvariation ($\Delta V$) mit der Zurückgelegter Weg ($dx$) gleich ist:
| $ \Delta V = S \Delta s $ |
Die Gleichung für der Differential ungenaue Arbeits ($\delta W$) kann wie folgt ausgedrückt werden:
| $ \delta W = F dx $ |
Daher kann sie geschrieben werden als:
| $ \delta W = p dV $ |
ID:(11126, 0)
Erster Hauptsatz der Thermodynamik und Druck
Konzept 
Da der Interne Energiedifferenz ($dU$) in Beziehung zu der Differential ungenau Wärme ($\delta Q$) und der Differential ungenaue Arbeits ($\delta W$) steht, wie unten gezeigt:
| $ dU = \delta Q - \delta W $ |
Und es ist bekannt, dass der Differential ungenaue Arbeits ($\delta W$) in Beziehung zu die Druck ($p$) und die Volumenvariation ($\Delta V$) steht, wie folgt:
| $ \delta W = p dV $ |
Daher können wir schlussfolgern, dass:
| $ dU = \delta Q - p dV $ |
ID:(15701, 0)
Erster Hauptsatz der Thermodynamik
Modell 
Das erste Gesetz der Thermodynamik besagt, dass Energie erhalten bleibt und sich aus zwei Komponenten zusammensetzt: einer, die mit Arbeit verbunden ist, und einer anderen, die mit Wärme verbunden ist. Im Gegensatz zur Arbeit kann dieser letztere Teil nicht vollständig in Arbeit umgewandelt werden, was die möglichen Energieumwandlungen einschränkt.
Variablen
Berechnungen
Berechnungen
Gleichungen
(ID 3202)
Da die Mechanische Kraft ($F$) geteilt durch die Abschnitt ($S$) gleich die Druck ($p$) ist:
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
und die Volumenvariation ($\Delta V$) mit der Zurückgelegter Weg ($dx$) gleich ist:
| $ \Delta V = S \Delta s $ |
Die Gleichung f r der Differential ungenaue Arbeits ($\delta W$) kann wie folgt ausgedr ckt werden:
| $ \delta W = F dx $ |
Daher kann sie geschrieben werden als:
| $ \delta W = p dV $ |
(ID 3468)
(ID 3469)
Da der Interne Energiedifferenz ($dU$) in Beziehung zu der Differential ungenau Wärme ($\delta Q$) und der Differential ungenaue Arbeits ($\delta W$) steht, wie unten gezeigt:
| $ dU = \delta Q - \delta W $ |
Und es ist bekannt, dass der Differential ungenaue Arbeits ($\delta W$) in Beziehung zu die Druck ($p$) und die Volumenvariation ($\Delta V$) steht, wie folgt:
| $ \delta W = p dV $ |
Daher k nnen wir schlussfolgern, dass:
| $ dU = \delta Q - p dV $ |
(ID 3470)
(ID 15700)
(ID 15701)
Beispiele
Das erste Gesetz der Thermodynamik, auch als Gesetz der Energieerhaltung bekannt, besagt, dass Energie in einem isolierten System weder erschaffen noch zerst rt werden kann; sie kann nur bertragen oder umgewandelt werden. Dieses Prinzip besagt, dass die Gesamtenergie eines isolierten Systems konstant bleibt. In praktischen Begriffen bedeutet dies, dass die nderung der inneren Energie eines Systems gleich der hinzugef gten W rme abz glich der vom System geleisteten Arbeit ist. Die innere Energie umfasst die gesamte Energie innerhalb eines Systems, einschlie lich der kinetischen und potenziellen Energie auf molekularer Ebene. W rme ist die Energie, die zwischen Systemen aufgrund eines Temperaturunterschieds bertragen wird, w hrend Arbeit die Energie ist, die bertragen wird, wenn eine Kraft ber eine Strecke ausge bt wird, oft in Zusammenhang mit Volumen nderungen in Gasen. Das erste Gesetz ist grundlegend f r die Analyse der Effizienz von W rmekraftmaschinen, die Leistung von K hl- und Heizsystemen und das Verst ndnis von Stoffwechselprozessen in biologischen Systemen. Es bildet die Grundlage f r das Verst ndnis von Energie bertragungen und -umwandlungen in verschiedenen physikalischen Prozessen und stellt sicher, dass die Energie innerhalb eines isolierten Systems immer erhalten bleibt.
(ID 15250)
Das erste Gesetz der Thermodynamik besagt, dass Energie immer erhalten bleibt.W hrend in der Mechanik eine hnliche Erhaltung formuliert wird, die auf nicht dissipative Systeme beschr nkt ist (zum Beispiel unter Ausschluss von Reibung), generalisiert die Thermodynamik dies, indem sie nicht nur die mechanische Arbeit, sondern auch die vom System erzeugte oder absorbierte W rme ber cksichtigt.In diesem Sinne gibt es keine Einschr nkungen f r die in der Thermodynamik postulierte Energieerhaltung und sie gilt f r alle Systeme, solange alle m glichen Energieaustausche und -umwandlungen ber cksichtigt werden.
(ID 37)
Betrachten wir ein Gas in einem Zylinder, in dem sich ein Kolben bewegen kann. Wenn der Kolben bewegt wird, kann das Gasvolumen durch Kompression verringert werden. F r diese Kompression wird Energie ben tigt, die gleich der vom Gas ausge bten Kraft multipliziert mit der zur ckgelegten Strecke des Kolbens ist. Diese Energie kann auch in Bezug auf den Druck dargestellt werden, da Druck durch die Kraft und den Querschnitt des Kolbens definiert wird.

Arbeit kann am System geleistet werden (Kompression) oder vom System auf die externe Umgebung bertragen werden (Expansion).
Da die Mechanische Kraft ($F$) geteilt durch die Abschnitt ($S$) gleich die Druck ($p$) ist:
| $ p \equiv\displaystyle\frac{ F }{ S }$ |
und die Volumenvariation ($\Delta V$) mit der Zurückgelegter Weg ($dx$) gleich ist:
| $ \Delta V = S \Delta s $ |
Die Gleichung f r der Differential ungenaue Arbeits ($\delta W$) kann wie folgt ausgedr ckt werden:
| $ \delta W = F dx $ |
Daher kann sie geschrieben werden als:
| $ \delta W = p dV $ |
(ID 11126)
(ID 15309)
ID:(1398, 0)
