Pression osmotique
Storyboard 
La pression osmotique se génère dans une solution en présence d'une membrane semi-perméable. Cette membrane permet au solvant de passer tout en retenant le soluté d'un côté, ce qui crée un déséquilibre de pression. En conséquence, la pression diminue du côté du solvant pur, ce qui pousse le solvant à traverser la membrane vers le côté contenant le soluté.
Ce processus se poursuit jusqu'à ce que la pression du côté contenant le soluté augmente suffisamment pour compenser la diminution initiale de pression, ou jusqu'à ce que le soluté se dilue suffisamment pour éliminer la différence de pression, atteignant ainsi un équilibre osmotique.
ID:(660, 0)
Phase gazeuse, vapeur d'eau
Noter 
La phase gazeuse, qui dans notre cas correspond à la vapeur d'eau, est la phase dans laquelle les atomes peuvent se déplacer relativement librement.

Dans cette phase, il n'y a qu'une interaction minimale qui peut influencer le comportement des atomes sans les confiner de manière significative.
ID:(15142, 0)
Phase liquide, eau
Citation 
La phase liquide, qui dans notre cas correspond à l'eau, est la phase dans laquelle les atomes peuvent se déplacer relativement librement tout en maintenant leur unité et en s'adaptant à la forme qui les contient.

Dans cette phase, aucune structure spécifique n'est observée.
ID:(15140, 0)
Phase solide, glace
Exercer 
La phase solide, qui dans notre cas correspond à la glace, est la phase dans laquelle les atomes ne peuvent pas se déplacer relativement et ne peuvent que osciller autour de leur point d'équilibre.

Dans cette phase, on peut observer une structure qui est souvent cristalline et donc régulière.
ID:(15141, 0)
Schéma de la phase de l'eau
Équation 
L'un des diagrammes de phase les plus pertinents pour notre planète est celui de l'eau. Ce diagramme présente les trois phases classiques : solide, liquide et gazeuse, ainsi que plusieurs phases avec différentes structures cristallines de la glace.
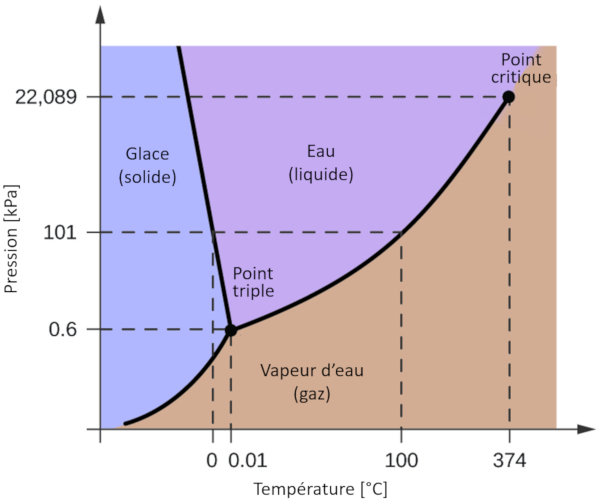
La caractéristique la plus notable par rapport à d'autres matériaux est que, dans une plage de pression allant de 611 Pa à 209,9 MPa, la phase solide occupe un volume plus important que la phase liquide. Cette particularité se reflète dans le diagramme de phase sous la forme d'une pente négative le long de la ligne de séparation entre la phase solide (glace hexagonale) et la phase liquide (eau).
ID:(836, 0)
Pression osmotique
Storyboard 
La pression osmotique se génère dans une solution en présence d'une membrane semi-perméable. Cette membrane permet au solvant de passer tout en retenant le soluté d'un côté, ce qui crée un déséquilibre de pression. En conséquence, la pression diminue du côté du solvant pur, ce qui pousse le solvant à traverser la membrane vers le côté contenant le soluté. Ce processus se poursuit jusqu'à ce que la pression du côté contenant le soluté augmente suffisamment pour compenser la diminution initiale de pression, ou jusqu'à ce que le soluté se dilue suffisamment pour éliminer la différence de pression, atteignant ainsi un équilibre osmotique.
Variables
Calculs
Calculs
Équations
S'il existe a différence de pression ($\Delta p$) entre deux points, comme le d termine l' quation :
nous pouvons utiliser a pression de la colonne d'eau ($p$), qui est d finie comme suit :
Cela donne :
$\Delta p=p_2-p_1=p_0+\rho_wh_2g-p_0-\rho_wh_1g=\rho_w(h_2-h_1)g$
Comme a différence de hauteur ($\Delta h$) est d finie comme suit :
a différence de pression ($\Delta p$) peut tre exprim e comme suit :
Le nombre de taupes ($n$) correspond le nombre de particules ($N$) divis par le numéro d'Avogadro ($N_A$) :
Si nous multiplions la fois le num rateur et le d nominateur par a masse molaire ($m$), nous obtenons :
$n=\displaystyle\frac{N}{N_A}=\displaystyle\frac{Nm}{N_Am}=\displaystyle\frac{M}{M_m}$
Donc, c'est :
Exemples
Si l'on place une membrane semi-perm able au fond d'un tube en forme de U et que l'on ajoute de l'eau, on peut observer que l'ajout de mati re dissoute entra ne une l vation de la colonne contenant le solut :
Cela est d la pression n gative r sultante de la pression osmotique.
A pression osmotique ($\Psi$) se comporte comme la pression dun gaz id al de le nombre d'ions ($N_s$) dans le volume ($V$) A température absolue ($T$), en utilisant a constante du gaz universel ($R_C$), comme d crit par :
Si deux colonnes d'eau sont s par es leur base par une membrane semi-perm able qui permet le passage de l'eau mais bloque le solut pr sent dans l'une d'elles, les colonnes pr senteront des hauteurs diff rentes. Cela s'explique par le fait que la pr sence d'un solut r duit la pression osmotique, entra nant un ajustement de la hauteur de la colonne pour quilibrer la diff rence de pression.
Si la pression dans la premi re colonne est a pression dans la colonne 1 ($p_1$), la pression dans la seconde colonne (sans solut ) est a pression dans la colonne 2 ($p_2$), et la pression osmotique est a pression osmotique ($\Psi$), la relation peut tre exprim e comme suit :
La diff rence de hauteur, repr sent e par a différence de hauteur ($\Delta h$), implique que la pression dans les deux colonnes est diff rente. En particulier, a différence de pression ($\Delta p$) est une fonction de a densité du liquide ($\rho_w$), a accélération gravitationnelle ($g$), et a différence de hauteur ($\Delta h$), comme suit :
Lorsque deux colonnes de liquide sont connect es avec a hauteur de colonne de liquide 1 ($h_1$) et a hauteur de colonne de liquide 2 ($h_2$), une a différence de hauteur ($\Delta h$) est form e, qui est calcul e comme suit :
a différence de hauteur ($\Delta h$) g n rera la diff rence de pression qui fera s' couler le liquide de la colonne la plus lev e vers la colonne la plus basse.
Lorsque deux colonnes de liquide sont connect es avec a pression dans la colonne 1 ($p_1$) et a pression dans la colonne 2 ($p_2$), une a différence de pression ($\Delta p$) est cr e, qui est calcul e selon la formule suivante :
a différence de pression ($\Delta p$) repr sente la diff rence de pression qui fera s' couler le liquide de la colonne la plus haute vers la colonne la plus basse.
Le nombre de taupes ($n$) correspond le nombre de particules ($N$) divis par le numéro d'Avogadro ($N_A$) :
le numéro d'Avogadro ($N_A$) est une constante universelle de valeur 6.028E+23 1/mol ; elle nest donc pas incluse parmi les variables utilis es dans le calcul.
Le nombre de taupes ($n$) est d termin en divisant a masse ($M$) d'une substance par son a masse molaire ($M_m$), ce qui correspond au poids d'une mole de la substance.
Par cons quent, la relation suivante peut tre tablie :
La masse molaire est exprim e en grammes par mole (g/mol).
A pression de la colonne d'eau ($p$) est avec a densité du liquide ($\rho_w$), a hauteur de la colonne ($h$), a accélération gravitationnelle ($g$) et a pression atmosphèrique ($p_0$) gal xa0:
A pression de la colonne d'eau ($p$) est avec a densité du liquide ($\rho_w$), a hauteur de la colonne ($h$), a accélération gravitationnelle ($g$) et a pression atmosphèrique ($p_0$) gal xa0:
ID:(660, 0)
